题目内容
20.SO2和Cl2均是常用的漂白剂,若将SO2和Cl2等物质的量混合后,先缓慢通入到BaCl2溶液中,再滴入品红试液,会观察到的现象是( )| A. | 无沉淀生成,溶液显红色 | B. | 无沉淀生成,溶液显无色 | ||
| C. | 有沉淀生成,溶液显无色 | D. | 有沉淀生成,溶液显红色 |
分析 二氧化硫与氯气等物质的量混合后,恰好反应生成硫酸和盐酸,通入氯化钡,硫酸与氯化钡反应生成硫酸钡沉淀,滴入品红,溶液不褪色,据此解答.
解答 解:SO2和Cl2均是常用的漂白剂,若将SO2和Cl2等物质的量混合恰好反应生成硫酸和盐酸,方程式:Cl2+SO2+2H2O=H2SO4+2HCl,H2SO4和HCl都不具有漂白性,硫酸与氯化钡反应生成硫酸钡沉淀,反应后溶液中无漂白物质,所以溶液显无色,
故选:D.
点评 本题考查了元素化合物知识,明确氯气与二氧化硫的性质是解题关键,注意二氧化硫与次氯酸漂白原理的不同.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
16.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 1molP4含有p-p键的个数为4NA | |
| B. | 1molSiC中含有C-Si键的个数为2NA | |
| C. | 含C为1mol的金刚石中含有C-C键的个数为2NA | |
| D. | 1molSi02中含Si-O键的个数为2NA |
11.下列物质的使用不涉及化学变化的是( )
| A. | 氢氟酸刻蚀玻璃 | B. | 四氯化碳作萃取剂 | ||
| C. | 氯气用子自来水消毒 | D. | 氢氧化铝用作胃酸中和剂 |
8.下列各组离子中,可以大量共存的是( )
| A. | Na+、Ba2+、SO42-、Cl- | B. | H+、Ag+、Cl-、NO3- | ||
| C. | K+、H+、CO32-、Cl- | D. | Na+、Mg2+、Cl-、NO3- |
15.下列有机物命名正确的是( )
| A. | 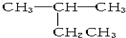 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. |  间二甲苯 间二甲苯 | D. | 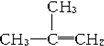 2-甲基-2-丙烯 2-甲基-2-丙烯 |
12.短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
| A. | 质子数:C>d | B. | 离子还原性:Y>Z | C. | 稳定性:H2Y>HZ | D. | 原子半径:X<W |
 ,此烃名称为3-甲基-2-乙基-1-戊烯.
,此烃名称为3-甲基-2-乙基-1-戊烯. ,其一氯代物有5种.
,其一氯代物有5种. ,之后再进行分液操作.
,之后再进行分液操作.