题目内容
2.有机物分子式为C5H11Cl,其可能的结构有多少种( )| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
分析 判断和书写烷烃的氯代物的异构体可以按照以下步骤来做:(1)先确定烷烃的碳链异构,即烷烃的同分异构体. (2)确定烷烃的对称中心,即找出等效的氢原子. (3)根据先中心后外围的原则,将氯原子逐一去代替氢原子. (4)对于多氯代烷的同分异构体,遵循先集中后分散的原则,先将几个氯原子集中取代同一碳原子上的氢,后分散去取代不同碳原子上的氢.
解答 解:分子式为C5H11Cl的同分异构体有
主链有5个碳原子的:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3;
主链有4个碳原子的:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;
主链有3个碳原子的:CH2C(CH3)2CH2Cl;
共有8种情况.
故选D.
点评 本题考查以氯代物的同分异构体的判断,难度不大,做题时要抓住判断角度,找出等效氢原子种类.一般说来,同一个碳原子上的氢原子等效,同一个碳原子上连的所有甲基上的氢原子等效,处于镜面对称位置上的氢原子等效.氯原子取代任意一个等效氢原子所得的一氯代物是同一种.只要这样就可以了.比如说丙烷有两种一氯代物.

练习册系列答案
相关题目
12.短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
| A. | 质子数:C>d | B. | 离子还原性:Y>Z | C. | 稳定性:H2Y>HZ | D. | 原子半径:X<W |
7.在0.1mol•L-1的CH3COOH溶液中存在CH3COOH?CH3COO-+H+电离平衡,对于该平衡下列叙述正确的是( )
| A. | 加入少量Na2CO3固体,平衡不移动 | |
| B. | 加大量的水后,反应速率增大,平衡向逆反应方向移动 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 滴加少量0.1 mol•L-1HCl溶液,溶液中c(H+)减少 |
14.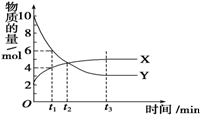 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的1.5倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,逆反应速率大于正反应速率 |
12.A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
请回答下列问题:
(1)E在元素周期表中的位置第四周期第Ⅷ族;D原子结构示意图是
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单气态氢化物中稳定性较大的是H2O
(3)B、C的单质按物质的量比1:2形成的化合物中化学键的类型为离子键、好几件;该化合物电子式为 .
.
(4)E的一种具有磁性的黑色晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 焰色反应呈黄色 |
| D | 与B同主族的短周期元素 |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
(1)E在元素周期表中的位置第四周期第Ⅷ族;D原子结构示意图是

(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单气态氢化物中稳定性较大的是H2O
(3)B、C的单质按物质的量比1:2形成的化合物中化学键的类型为离子键、好几件;该化合物电子式为
 .
.(4)E的一种具有磁性的黑色晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.
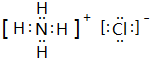 .
.