题目内容
7.3.01×1023个OH-的物质的量为0.5mol,质量为8.5g,它与标准状况下11.2L的NH3的物质的量相等,与11.5gNa+含有的离子数目相同.分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$结合物质的构成计算.
解答 解:n(OH-)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,m(OH-)=0.5mol×17g/mol=8.5g,
V(NH3)=0.5mol×22.4L/mol=11.2L,
m(Na+)=0.5mol×23g/mol=11.5g.
故答案为:0.5mol;8.5g;11.2;11.5.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.

甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
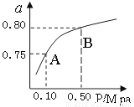
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(2)反应②是 (填“吸热”或“放热”)反应。
(3)判断反应③△H 0;△S 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t 0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(5)一定温度下,C(s)和水蒸气在密闭容器中,建立平衡状态:C(s)+H2O(g) CO(g)+H2(g);ΔH>0。
CO(g)+H2(g);ΔH>0。
①平衡时混合气体的平均相对分子质量Mr(平)的取值范围为__________>Mr(平)>__________。
②若使用CO和H2从逆反应方向在相同温度下建立平衡,则平衡混合气体的平均相对分子质量M′r(平)的取值范围为__________>M′r(平)>__________。
| A. | 9.0L | B. | 11.2L | C. | 16.8L | D. | 17.92L |
| A. | 味觉上有酸味的食物即酸性食物 | |
| B. | 生石灰可防止食物受潮,铁粉可防止食物氧化变质 | |
| C. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 | |
| D. | 食品添加剂苯甲酸钠是有毒,所以应该禁止添加食品添加剂 |
| A. | 常温常压下,11.2L NH3所含的原子数为2NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 56gCO所含的分子数为3NA |
| A. | 1mol铵根离子中含有的电子数为9NA | |
| B. | 16g氧气和臭氧的混合物中含有NA个氧原子 | |
| C. | 8g甲烷分子中所含共用电子对数为2NA | |
| D. | 31g白磷P4中含有0.25NA个正四面体构型的分子 |
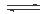 CH3OH(g)
CH3OH(g)