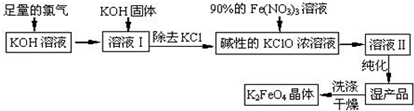
题目内容
15.根据化合物:①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3•H2O ⑧H2O回答下列问题.
(1)NH4Cl溶液显酸性,用离子方程式表示原因:NH4++H2O=NH3•H2O+H+,其溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(2)常温下,pH=11的CH3COONa溶液中,由水电离出来的c(OH-)=10-3mol/L,在pH=3的CH3COOH溶液中,由水电离出来的c(H+)=10-11mol/L.
(3)已知纯水中存在平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是D(填字母序号).
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m<n(填“<”、“>”或“=”).
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为②>⑦>⑤>①>④>⑥>③.
分析 (1)铵根离子水解,使溶液呈酸性,一般情况下盐的水解程度都比较小;
(2)CH3COONa溶液中,醋酸根水解,促进水的电离,所以溶液中水电离出的氢氧根离子就是溶液中的氢氧根离子,CH3COOH溶液中,水电离受到抑制,水电离出来的氢离子等于溶液中的氢氧根离子,据此计算;
(3)欲使平衡向右移动,且所得溶液显酸性,可加入水解呈酸性的盐;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离;
(5)溶液中氢离子浓度越大,则其pH越小,按照溶液中氢离子浓度由小到大顺序进行排列.
解答 解:(1)铵根离子水解,使溶液呈酸性,用离子方程式表示为NH4++H2O=NH3•H2O+H+,一般情况下盐的水解程度都比较小,所以溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;NH4++H2O=NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)pH=11的CH3COONa溶液中,醋酸根水解,促进水的电离,所以溶液中水电离出的氢氧根离子就是溶液中的氢氧根离子,水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,在pH=3的CH3COOH溶液中,水电离受到抑制,水电离出来的氢离子等于溶液中的氢氧根离子,水电离出来的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,
故答案为:10-3mol/L;10-11mol/L;
(3)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;
B.向水中加Na2CO3固体,水解呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;
故答案为:D;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(5)①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3•H2O,
显示碱性的为:②NaOH、⑤CH3COONa,⑦NH3•H2O,氢氧化钠为强碱,NH3•H2O为弱碱,CH3COONa为盐,所以pH②>⑦>⑤;
显示中性的为①NaCl,pH=7;
显示酸性的为:③HCl ④NH4Cl⑥CH3COOH,浓度相同时,盐酸为强酸,氢离子浓度最大,醋酸为一元弱酸,氢离子浓度小于盐酸,而氯化铵为强酸弱碱盐,氢离子浓度较小,所以三种酸性溶液的pH大小关系为:④>⑥>③,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑦>⑤>①>④>⑥>③,
故答案为:②>⑦>⑤>①>④>⑥>③.
点评 本题考查了离子浓度大小比较、水的电离及其影响因素、弱电解质的电离平衡等知识,题目难度中等,试题涉及的题量较大,充分考查了学生对所学知识的掌握情况,明确溶液中水电离的氢离子浓度大小的计算方法.

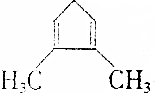 )与溴的四氯化碳溶液反应,产物最多有( )
)与溴的四氯化碳溶液反应,产物最多有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
①NaHSO4(l)
②NaHSO4 (aq)
③NaHCO3 (aq)
④H2CO3 (aq)
| A. | ①②③④ | B. | ④②③① | C. | ②③①④ | D. | ②①③④ |
| A. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 反应物的总焓大于生成物的总焓时,△H>0 |
(1)按物质的分类方法填写表格的空白处 (填编号):
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 | ②⑦⑧⑨⑩ | ①③⑤⑥⑩ | ④⑪ |
(3)将⑨滴加到⑦中至过量的实验现象是先产生沉淀后溶解.
(4)将③通入⑧中至恰好完全反应,则溶液导电能力的变化为导电能力逐渐增强.
| A. | $\frac{ac}{22400}$mol•L-1 | B. | $\frac{a}{22.4b}$mol•L-1 | ||
| C. | $\frac{ac}{22400b+36.5}$mol•L-1 | D. | $\frac{1000ac}{22.4b+36.5a}$mol•L-1 |