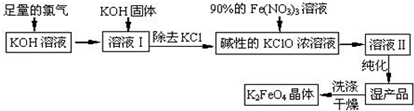
题目内容
18.一定量的CuS和Cu2S的混合物投入足量的浓HNO3中,收集到NO2气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO为8.0g,则V可能为( )| A. | 9.0L | B. | 11.2L | C. | 16.8L | D. | 17.92L |
分析 利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=$\frac{m}{M}$计算n(CuO),根据电子转移守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO2),根据V=nVm计算气体体积,实际气体介于二者之间.
解答 解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)=$\frac{8.0g}{80g/mol}$=0.1mol,转移电子物质的量=0.1×(6+2)=0.8mol.则NO2的物质的量为0.8mol,
故气体体积V=0.8mol×22.4L/mol=17.92L;
若混合物全是Cu2S,其物质的量n(Cu2S)=$\frac{1}{2}$n(CuO)=$\frac{1}{2}$×0.1mol=0.05mol,转移电子物质的量0.05×10=0.5mol,
设NO2为xmol,x=$\frac{0.5mol}{5-4}$=0.5mol,气体体积0.5mol×22.4L/mol=11.2L,
故选C.
点评 本题考查氧化还原反应计算,难度中等,注意守恒思想与极限法的利用,是对学生综合能力的考查.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
8.某气态烃与氧气在120℃时,混合于密闭容器中,点燃充分燃烧后,恢复到原温度时压强不变,则该烃可能是( )
①CH4 ②C2H4 ③C2H6 ④C3H4 ⑤C3H8 ⑥C3H6.
①CH4 ②C2H4 ③C2H6 ④C3H4 ⑤C3H8 ⑥C3H6.
| A. | ③⑥ | B. | ②⑤ | C. | ①②③ | D. | ①②④ |
13.在25℃和1.01×105Pa时,反应(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ/mol能自发进行的合理解释( )
| A. | 该反应熵判据起决定作用 | B. | 该反应焓判据起决定作用 | ||
| C. | 该反应是熵减的反应 | D. | 该反应是分解反应 |
3.等物质的量下列各状态的电解质,自由离子数由大到小的顺序是( )
①NaHSO4(l)
②NaHSO4 (aq)
③NaHCO3 (aq)
④H2CO3 (aq)
①NaHSO4(l)
②NaHSO4 (aq)
③NaHCO3 (aq)
④H2CO3 (aq)
| A. | ①②③④ | B. | ④②③① | C. | ②③①④ | D. | ②①③④ |
10.下列对化学反应的认识正确的是( )
| A. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 反应物的总焓大于生成物的总焓时,△H>0 |
8.下列化学反应的离子方程式能用H++OH-═H2O表示的是( )
| A. | H2SO4+Ba(OH)2═BaSO4+2H2O | B. | 2NaOH+H2SO4═2H2O+Na2SO4 | ||
| C. | CH3COOH+NaOH═CH3COONa+H2O | D. | HNO3+KOH═KNO3+H2O |
 CO(g)+H2(g)在一密闭容器中进行,下列说法或结论能够成立的是( )
CO(g)+H2(g)在一密闭容器中进行,下列说法或结论能够成立的是( )