��Ŀ����
����Ŀ��Na2S2O3��5H2O����Ϊ��Ч���ȼ�����ҵ����������(FeS2)Ϊԭ���Ʊ������ʵ�������ͼ��
![]()
��֪��a.����A����ʹƷ����Һ��ɫ��������(H2S)����ܻ�õ�����
b.pHԼΪ11�������£����������������ο��Թ���������������Ρ�
�ش��������⣺
��1���������е�ԭ��B����ѡ��__(����ĸ���)��
A.NaCl��Һ B.Na2CO3��Һ C.Na2SO4��Һ
��2��ijС��ͬѧ����ͼװ��ģ���Ʊ�Na2S2O3�Ĺ���(����װ������ȥ)��

��A��ʹ��70�����������98%��Ũ���ᷴӦ���ʿ죬��ԭ����__��װ��B��������__��
��C���Ʊ�Na2S2O3������������Ӧ�У�Na2S+H2O+SO2=Na2SO3+H2S��__��Na2SO3+S![]() Na2S2O3��
Na2S2O3��
��3������ʦ����˴��������õ�����Ĺ��գ���������������ù�����ϡ�����ȡ���õ���������������壬�÷�Ӧ�Ļ�ѧ����ʽΪ__��
���𰸡�B �÷�Ӧ��ʵ����H+��SO32-��Ӧ��70%�������к�ˮ�϶࣬c(H+)��c(SO32-)���ϴ�����SO2���ʸ��죨����ǿ��Ũ�����������Է�����ʽ���ڣ� ��ֹ���� 2H2S+SO2=3S+2H2O(��2H2S+H2SO3=3S��+3H2O) FeS2+2HCl=FeCl2+H2S��+S��
��������
�������ڷ���¯��ȼ�������������������������A�Ƕ���������ҺD����Ũ������ȴ�ᾧ�õ���������ƾ��壬DΪNa2S2O3�����������������ο��Թ���������������Σ�����ҺCΪNa2SO3����������BҪ������SO2����Na2SO3������ԭ��B����Ϊ̼������Һ������������Һ���������Ϸ������
(1)B���ն�������ת��Ϊ�������ƣ�̼���ƿ������������Ӧ�����������ƣ���NaCl�� Na2SO4���������Ӧ��
��ѡB��
(2)��AΪ�Ʊ��������÷�Ӧ��ʵ����H+��SO32-��Ӧ��70%�������к�ˮ�϶࣬c(H+)��c(SO32-)���ϴ�����SO2���ʸ��죬��Ũ�����������Է�����ʽ���ڣ��������������Ũ�Ⱥܵͣ���˷�Ӧ��������������C����������Һ��Ӧ�õ����⣬�������������Ӧ�õ�S���ʣ�S�������������Ʒ�Ӧ�õ���������ƣ�C�з�Ӧ����װ����ѹǿ��С��Bװ�õ������Ƿ�ֹ������
��Ϊ���÷�Ӧ��ʵ����H+��SO32-��Ӧ��70%�������к�ˮ�϶࣬c(H+)��c(SO32-)���ϴ�����SO2���ʸ��죨����ǿ��Ũ�����������Է�����ʽ���ڣ�����ֹ������
��C���Ʊ�Na2S2O3������������Ӧ�У�Na2S+H2O+SO2=Na2SO3+H2S��2H2S+SO2=3S+2H2O(��2H2S+H2SO3=3S��+3H2O) ��Na2SO3+S![]() Na2S2O3��
Na2S2O3��
����2H2S+SO2=3S+2H2O(��2H2S+H2SO3=3S��+3H2O)��
(3)��������Ϣ��֪��FeS2��HCl��Ӧ����H2S��S��ͬʱ������FeCl2��������Ϣд����Ӧ����ʽΪ��FeS2+2HCl=FeCl2+H2S��+S����
����FeS2+2HCl=FeCl2+H2S��+S�� ��

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д� �߽�������ϵ�д�
�߽�������ϵ�д�����Ŀ����Ԫ�����������õ�������ѧ���ʣ����㷺Ӧ�������������С��Ӻ��ܷ���(��CoO��Co2O3������Al��Li��)����ȡ��CoCl2��6H2O������������ʾ��
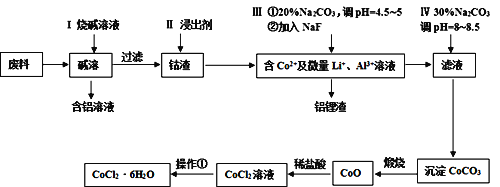
��ش��������⣺
(1)����I����Ҫ�����Ļ�ѧ��Ӧ����ʽΪ______��
(2)��֪Co2O3����ǿ�����ԣ�������II�н�����Ϊ���ᣬ��ɵĺ����_______��
(3)�������Тٵ�Ŀ���dz�ȥAl3+��д���ò���Ӧ�����ӷ���ʽ______��
(4)����ʵ��������CoCO3������Ĺ��������������ƾ��ƺͲ������⣬����______��______(����������)��
(5)����������HCl��Χ�н��еģ��䲽����______��_____�����ˡ�ϴ�ӡ����ϴ�ӹ����п����ù�ҵ�ƾ�����ˮ�����ŵ���_____��
(6)ijͬѧ�ñ���������Һ�ζ�δ֪Ũ�ȵ�CoCl2��Һ�����п���Ϊָʾ������____(��ѡ������������ӵ���ɫ����)
A��KCl B��KSCN C��K2CrO4 D��K2S
��֪����������20��ʱ����ɫ��Kspֵ���±�
��ѧʽ | AgCl | AgSCN | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ |
Ksp | 2.0��10-10 | 1.0��10-12 | 2.0��10-48 | 2.0��10-12 |







