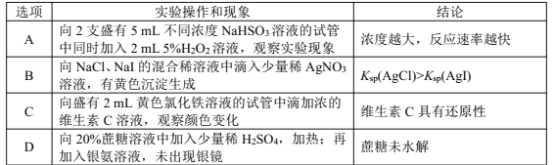
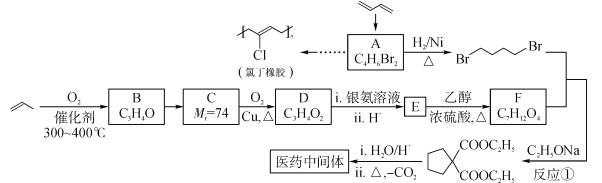
题目内容
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
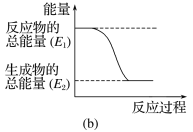
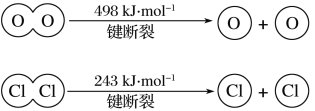
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在的一能定量温为度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
![]()
①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
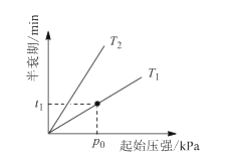
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
【答案】NH4NO3![]() N2O↑+2H2O 1112.5 1.0
N2O↑+2H2O 1112.5 1.0![]() 10-3 20.0% > 1.25p0 AC
10-3 20.0% > 1.25p0 AC
【解析】
(1)硝酸铵在催化剂下分解生成一氧化二氮和水,配平即可;
(2)根据反应热=反应物的键能总和-生成物的键能总和计算键能;
①根据表格数据,代入速率公式计算反应速率;
②单位时间内c(N2O)的变化与N2O的起始浓度无关,每10min均减小0.01mol/L,若N2O起始浓度c0为0.150mol/L ,则反应至30min时转化的N2O的浓度为0.01mol/L![]() 3=0.03mol/L,代入转化率计算公式计算;
3=0.03mol/L,代入转化率计算公式计算;
③其他条件相同时,温度升高化学反应速率加快,N2O分解半衰期减小,据此分析;
列出三段式,求出t1min时总物质的量为(0.5+0.5+0.25)mol=1.25mol,再根据等温等容条件下,压强之比等于物质的量之比,计算体系压强;
(4)A.温度升高,化学反应速率增大,因v=k·c(N2O)·[c(I2)]0.5,则温度升高,k值增大;
B.化学反应速率由反应最慢的反应决定,则第二步对总反应速率起决定作用;
C.第二步反应为慢反应,第三步反应为快反应,所以第二步活化能比第三步大;
D.含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5,所以N2O分解速率与I2浓度有关。
(1)硝酸铵在催化剂下分解生成一氧化二氮和水,反应的化学方程式为NH4NO3![]() N2O↑+2H2O,
N2O↑+2H2O,
故答案为:NH4NO3![]() N2O↑+2H2O;
N2O↑+2H2O;
(2)2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,设1molN2O(g)分子中化学键断裂时需要吸收的能量为xkJ,根据反应热=反应物的键能总和-生成物的键能总和,
2x-2![]() 945kJ-498kJ=-163kJ,解得x=1112.5kJ;
945kJ-498kJ=-163kJ,解得x=1112.5kJ;
①根据表格数据,在0~20min时段,反应速率v(N2O)=![]() =
=![]() =1.0
=1.0![]() 10-3mol·L-1·min-1;
10-3mol·L-1·min-1;
②由表可知,每隔10min,c(N2O)的变化量相等,故单位时间内c(N2O)的变化与N2O的起始浓度无关,每10min均减小0.01mol/L,若N2O起始浓度c0为0.150mol/L ,则反应至30min时转化的N2O的浓度为0.01mol/L![]() 3=0.03mol/L,则N2O的转化率α=
3=0.03mol/L,则N2O的转化率α=![]() 100%=20.0%;
100%=20.0%;
③其他条件相同时,温度升高化学反应速率加快,N2O分解半衰期减小,由图可知,压强相同时,半衰期T2>T1,则温度T1 >T2;
当温度为T1、起始压强为p0,设起始时的物质的量为1mol,则,
2N2O(g)=2N2(g)+O2(g)
起始量(mol) 1 0 0
t1min时(mol) 0.5 0.5 0.25
t1min时总物质的量为(0.5+0.5+0.25)mol=1.25mol,根据等温等容条件下,压强之比等于物质的量之比,体系压强/span>p= ![]() p0=1.25p0,
p0=1.25p0,
故答案为:1112.5;20.0%;>;1.25p0;
(4)A.温度升高,化学反应速率增大,因v=k·c(N2O)·[c(I2)]0.5,则温度升高,k值增大,故A正确;
B.化学反应速率由反应最慢的反应决定,则第二步对总反应速率起决定作用,故B错误;
C.第二步反应为慢反应,第三步反应为快反应,所以第二步活化能比第三步大,故C正确;
D.含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5,所以N2O分解速率与I2浓度有关,故D错误。应选AC,
故答案为:AC。

【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________。
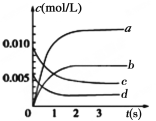
(2)如图中表示NO2的变化的曲线是________。用NO2表示从0~2s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a. v(NO2)=2v(O2) b. 容器内压强保持不变
c. 2v逆(NO)=v正(O2) d. 容器内气体的平均摩尔质量保持不变
(4)能使该反应的反应速率增大的是________。
a. 及时分离出NO2气体 b. 适当升高温度
c. 增大O2的浓度 d. 选择高效催化剂