题目内容
5.取浓度相等的NaOH和HCl溶液,以3:2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为( )| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.05mol/L | D. | 0.50mol/L |
分析 取浓度相等的NaOH和HCl溶液,以3:2体积比相混和后pH=12,说明碱过量,剩余的c(OH-)=0.01mol/L,据此列式计算原溶液的浓度.
解答 解:设NaOH和HCl的物质的量浓度均为x,NaOH和HCl溶液以3:2体积比相混合,体积分别为3V、2V,
酸碱混合后pH=12,则碱过量,剩余的氢氧根离子浓度为:c(OH-)=0.01mol/L,
则:c(OH-)=$\frac{3xV-2xV}{5V}$=0.01mol/L,
解得:x=0.05mol/L,
故选C.
点评 本题考查酸碱混合的pH的计算,题目难度中等,明确混合后pH=12为碱过量是解答本题的关键,并注意明确溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
15.不能发生消去反应的有机物是( )
| A. | CH3OH | B. | 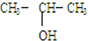 | ||
| C. | 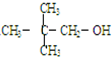 | D. | CH3-CH2-CH2-CH2OH |
13.C、N、S是重要的非金属元素,下列说法正确的是( )
| A. | 实验室用铜和浓硝酸反应制取NO | |
| B. | 三种元素均可以和氧元素形成多种氧化物 | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 稀硫酸、稀硝酸与铁的反应均属于置换反应 |
20.下列几组顺序排列不正确的是( )
| A. | 沸点高低:HI>HBr>HCl>HF | |
| B. | 热稳定性大小:HF>H2O>NH3>PH3 | |
| C. | 熔点高低:金刚石>食盐>金属钠>冰 | |
| D. | 微粒半径大小:S2->Cl->F->Na+>Al3+ |
10.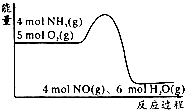 在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
 在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )| A. | 由图可知a>0 | |
| B. | 升高温度可以提高NH3的转化率 | |
| C. | 反应体系中加入催化剂可增加反应热 | |
| D. | 将平衡混合物通入水中一定有硝酸铵生成 |
17.下列有关有机物中可能在一个平面上的最多原子数目的判断中,正确的是( )
| A. | 丙烷最多6个原子处于同一平面 | |
| B. | 环己烷最多有12个原子处于同一平面上 | |
| C. | 苯乙烯最多有16个原子处于同一平面上 | |
| D. | CH3CH=CH-C≡C-CF3最多有10个原子处于同一平面上 |
15.在50mL FeCl3和CuCl2的混合溶液中,FeCl3和CuCl2的浓度均为1mol/L,在混合溶液中加入100mL NaOH溶液,恰好完全反应,则该NaOH溶液的浓度为( )
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |