题目内容
1.已知几种短周期元素的原子半径、常见的最高价和最低价如下表:| 元素性质 | 元素编号 | ||||||
| 原子半径(nm) | A | B | C | D | E | F | G |
| 0.073 | 0.075 | 0.037 | 0.110 | 0.099 | 0.186 | 0.143 | |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | -1 | -3 | -1 | 无 | 无 |
(1)B元素在周期表中的位置第二周期第VA族
(2)B的氢化物的沸点比D的氢化物的沸点高;(填:高、低或相等),其理由是氨气中含有氢键、膦不含氢键
(3)写出G的单质与F的最高价氧化物的水化物反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,它的水溶液显酸性(填:酸性、碱性或中性),其原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示).
(4)化合物甲由A、F两种元素组成的淡黄色物质中含有的化学键:离子键和共价键
(5)A、B的气态氢化物的稳定性强的是H2O(用化学式表示)
(6)由B、C两种元素组成的离子化合物
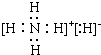 (用电子式表示)
(用电子式表示)(7)B与E两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则乙的结构式
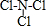 .
.
分析 这几种元素都是短周期元素,在短周期主族元素中,元素最高正化合价与其族序数相等,最低负价=族序数-8,原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,A位于第VIA族,且没有最高正化合价,则为O元素;
BD最高正价为+5价,位于第VA族,原子半径D>B,所以B是N、D是P元素;
C原子半径最小,其最高正化合价为+1价,位于第IA族,且有负化合价,所以为H元素;
E原子最高正化合价为+7价,为Cl元素;
F最高正化合价为+1价,位于第IA族,且原子半径大于Cl原子,所以为Na元素;
G最高正化合价为+3价,位于第IIIA族,原子半径大于Cl原子而小于Na原子,为Al元素;
再结合问题分析解答.
解答 解:这几种元素都是短周期元素,在短周期主族元素中,元素最高正化合价与其族序数相等,最低负价=族序数-8,原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,A位于第VIA族,且没有最高正化合价,则为O元素;
BD最高正价为+5价,位于第VA族,原子半径D>B,所以B是N、D是P元素;
C原子半径最小,其最高正化合价为+1价,位于第IA族,且有负化合价,所以为H元素;
E原子最高正化合价为+7价,为Cl元素;
F最高正化合价为+1价,位于第IA族,且原子半径大于Cl原子,所以为Na元素;
G最高正化合价为+3价,位于第IIIA族,原子半径大于Cl原子而小于Na原子,为Al元素;
(1)B为N元素,B元素在周期表中的位置第二周期第VA族,故答案为:第二周期第VA族;
(2)B的氢化物是氨气、D的氢化物是膦,含有氢键的氢化物熔沸点较高,氨气中含有氢键、膦中不含氢键,所以B的沸点比D的氢化物的沸点高,
故答案为:高;氨气中含有氢键、膦中不含氢键;
(3)G的单质是Al,F的最高价氧化物的水化物是NaOH,二者反应生成偏铝酸钠和氢气,反应的化学方程式2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
化合物甲由G、E两种元素组成,该化合物甲熔化时破坏了共价键,氯化铝是强酸弱碱盐,铝离子水解导致它的水溶液显酸性,
故答案为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑;共价键;酸性;Al3++3H2O?Al(OH)3+3H+;
(4)化合物甲由O、Na两种元素组成的淡黄色物质为Na2O2,Na2O2中含有的化学键为离子键和共价键,故答案为:离子键、共价键;
(5)元素的非金属性越强,其氢化物的稳定性越强,非金属性O>N,所以A、B的气态氢化物的稳定性强的是H2O,故答案为:H2O;
(6)B是N元素、C是H元素,由B、C两种元素组成的离子化合物是氢化铵,电子式为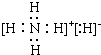 ,故答案为:
,故答案为: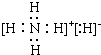 ;
;
(7)N与Cl两种元素形成的一种化合物乙,该化合物中各原子均满足8电子的稳定结构,则该化合物为NCl3,则乙的结构式 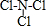 ,
,
故答案为: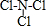 .
.
点评 本题考查物质位置结构性质相互关系及应用,涉及物质结构、元素周期律、物质性质、氢键等知识点,综合性较强,明确物质结构及其性质关系、元素周期律即可解答,注意氢化铵电子式的书写,为易错点.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 离子化合物可能含有共价键 | B. | 共价化合物可能含有离子键 | ||
| C. | 离子化合物只含有离子键 | D. | 以上说法均不正确 |
| A. | 气体总质量不变 | |
| B. | 反应物B的物质的量浓度不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | 物质C的生成速率和D的消耗速率之比为1:3 |
| A. | H2 | B. | CH2O2 | C. | C6H12O6 | D. | C12H22O11 |
| A. | H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强 | |
| B. | 根据非金属性强弱F>Cl,可以推测沸点HF>HCl | |
| C. | 进行H2O和H2S气体的热分解实验,可确定S、O两种元素的非金属性强弱 | |
| D. | 已知2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,说明C的非金属性比Si强 |
| A. | 实验室用铜和浓硝酸反应制取NO | |
| B. | 三种元素均可以和氧元素形成多种氧化物 | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 稀硫酸、稀硝酸与铁的反应均属于置换反应 |
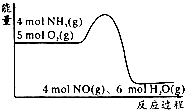 在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )| A. | 由图可知a>0 | |
| B. | 升高温度可以提高NH3的转化率 | |
| C. | 反应体系中加入催化剂可增加反应热 | |
| D. | 将平衡混合物通入水中一定有硝酸铵生成 |
| A. | 用碳棒作电极电解饱和MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | FeO溶于足量稀HNO3中:FeO+2H+═Fe2++H2O | |
| C. | 向苯酚钠溶液中通人少量CO2气体: +CO2+H2O→ +CO2+H2O→ ↓+CO32- ↓+CO32- | |
| D. | 向AlCl3溶液中加入过量氨水Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |