题目内容
20.对下列操作或实验现象的描述中,不正确的有(错选倒扣分)CEGA.同位素示踪技术常用于有机化学反应机理的确定,CH3CH218OH和CH3COOH在浓硫酸存在下加热,在反应后的混合溶液中可测出含O-18的乙酸乙酯.
B.在铁和盐酸的反应中加入少量固体硫酸铜能加快反应速率
C.将淀粉溶液滴在碘化钾试纸上,试纸变蓝色
D.向工业酒精中加入无水硫酸铜可鉴定是否有水存在
E.在实验室蒸馏石油的实验中,温度计的水银球应浸入石油液体中,以测量液体的温度
F.乙烯和二氧化硫都能使溴水褪色,但是两者的褪色原理不同
G.实验室制取乙酸乙酯时,向反应容器中依次加入浓硫酸、无水乙醇和冰醋酸
H.附着于试管内壁的油脂,可用热的烧碱溶液洗涤.
分析 A.乙酸和乙醇发生酯化反应时,乙醇中-OH中H-O键发生断键,乙酸-COOH中C-O键发生断裂;
B.原电池加快金属被腐蚀速率;
C.碘单质遇淀粉试液变蓝色;
D.无水硫酸铜检验水;
E.石油分馏时,温度计测量馏分温度;
F.乙烯和溴发生加成反应而使溴水褪色,二氧化硫将溴还原而使溴水褪色;
G.制取乙酸乙酯时,滴加溶液时先加密度小的后加密度大的;
H.油脂在碱性条件下水解生成高级脂肪酸钠和甘油.
解答 解:A.乙酸和乙醇发生酯化反应时,乙醇中-OH中H-O键发生断键,乙酸-COOH中C-O键发生断裂,所以CH3CH218OH和CH3COOH在浓硫酸存在下加热时,18O存在于乙酸乙酯中,故正确;
B.原电池加快金属被腐蚀速率,Fe置换出Cu,Fe、Cu和稀盐酸构成原电池,Fe易失电子作负极,所以加速被腐蚀,故正确;
C.碘单质遇淀粉试液变蓝色,KI中没有碘单质,所以不能使淀粉试液变蓝色,故错误;
D.水能使无水硫酸铜由无色变为蓝色,所以可以用无水硫酸铜检验水,故正确;
E.石油分馏时,温度计测量馏分温度,所以温度计水银球位于支管口处,故错误;
F.乙烯和溴发生加成反应而使溴水褪色,二氧化硫将溴还原而使溴水褪色,所以二者褪色原理不同,故正确;
G.制取乙酸乙酯时,滴加溶液时先加密度小的后加密度大的,所以加溶液先后顺序是:乙醇、乙酸、浓硫酸,故错误;
H.油脂在碱性条件下水解生成易溶于水的高级脂肪酸钠和甘油,所以可以用热的碱液洗涤油脂,故正确;
故选 CEG.
点评 本题考查化学实验方案评价,为高频考点,侧重考查实验原理、基本操作等知识点,明确物质性质及实验原理、操作规范性即可解答,易错选项是G.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
10.(1)管道煤气与天然气是常用的民用燃料.管道煤气的主要成分是CO、H2和少量烃类.天然气的主要成分是CH4.则(1)燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进气口(填“增大”或“减小”),若不作任何改进,可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO.
(2)管道煤气中含有烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是丁烷遇冷凝结为液体使管道内气流不畅.
(2)管道煤气中含有烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
11.下列关于化学键的叙述中,正确的是( )
| A. | 离子化合物可能含有共价键 | B. | 共价化合物可能含有离子键 | ||
| C. | 离子化合物只含有离子键 | D. | 以上说法均不正确 |
15.不能发生消去反应的有机物是( )
| A. | CH3OH | B. |  | ||
| C. | 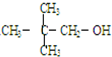 | D. | CH3-CH2-CH2-CH2OH |
5.世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用.下列说法正确的是( )
| A. | 二氧化氯是强氧化剂 | B. | 二氧化氯是强还原剂 | ||
| C. | 二氧化氯是电解质 | D. | 二氧化氯分子中氯为-1价 |
12.在一个恒温恒容的密闭容器中发生如下反应,2A(g)+2B(s)?C(g)+3D(g),不能说明该反应达到平衡的是( )
| A. | 气体总质量不变 | |
| B. | 反应物B的物质的量浓度不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | 物质C的生成速率和D的消耗速率之比为1:3 |
9.取A g某物质在氧气中完全燃烧,将其产物跟足量Na2O2固体完全反应,反应后固体质量增加大于A g,下列物质中能满足上述结果的是( )
| A. | H2 | B. | CH2O2 | C. | C6H12O6 | D. | C12H22O11 |
10.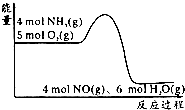 在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
 在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )
在一定条件下密闭容器中发生4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=akJ/mol.反应过程中能量变化如图所示,下列说法正确的是( )| A. | 由图可知a>0 | |
| B. | 升高温度可以提高NH3的转化率 | |
| C. | 反应体系中加入催化剂可增加反应热 | |
| D. | 将平衡混合物通入水中一定有硝酸铵生成 |

 ;元素的⑨离子结构示意图是
;元素的⑨离子结构示意图是 .
.