题目内容
9.NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 标准状况下,22.4L CCl4含有个NA个CCl4分子 | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 标准状况下,2.24 L溴乙烷中含共价键数目为0.7NA |
分析 A、依据甲醇结构分析化学键数目,1mol甲醇中含有C-H键的数目为3mol;
B、标准状况下四氯化碳不是气体;
C、依据甲苯和丙三醇的摩尔质量都是92g/mol、分子中都含有8g氢原子计算出2.3g混合物中含有的氢原子数目;
D、标准状况下,溴乙烷不是气体;
解答 A、甲醇结构简式CH3OH,1mol甲醇中含有C-H键的数目为3NA,故A错误;
B、标准状况下,22.4L CCl4含物质的量不是1mol,故B错误;
C、甲苯和丙三醇(C3H8O3)的摩尔质量相同为92g/mol,2.3g甲苯和丙三醇的混合物的物质的量=2.3g92g/mol=0.025mol,二者都含有8g氢原子,所以0.025mol混合物中含有0.2mol氢原子,含氢原子数目为0.2NA,故C正确;
D、标准状况下,2.24 L溴乙烷物质的量不是0.1mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用主要是物质结构特征,气体摩尔体积的应用条件分析,物质组成的结构特征是解题关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.当萘与H2以物质的量比为1:1发生加成反应时,与1,3-丁二烯发生1,4-加成相似的产物有( )
①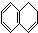 ②
② ③
③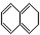 ④
④
①
 ②
② ③
③ ④
④
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
6.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 4.6gNO2和N2O4的混合气体中氧原子数小于0.2NA | |
| B. | 1 L 0.1 mol.L-1的Na2S溶液中离子总数小于0.3NA | |
| C. | 在标况下,2.24 L CCl4含有0.4NA个Cl原子 | |
| D. | 0.1 mol H2O2参加氧化还原反应时,不一定转移0.2NA个电子 |
4.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | 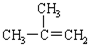 2-甲基-2-丙烯 2-甲基-2-丙烯 | ||
| C. | 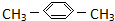 间二甲苯 间二甲苯 | D. | CH3CH2CH2CH2OH 1-丁醇 |
14.下列离子反应方程式,书写正确的是( )
| A. | 向碳酸钠溶液中加过量盐酸 CO32-+2H+=H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+=H2O+CO2↑ | |
| D. | .氢氧化钡溶液中加入硫酸 H++OH-=H2O |
1.已知aXm+和bYn-两种离子的电子层结构相同,则a等于( )
| A. | b+m+n | B. | b+m-n | C. | b-m+n | D. | b-m-n |
18.下表列出了A~R9种元素在周期表中的位置
用元素符号填写下空:
(1)化学性质最不活泼的元素是Ar
(2)这9中元素中金属性最强的是K
(3)A在F中燃烧得到产物的化学式Na2O2
(4)G的最高价含氧酸的化学式是HCl04
(5)C与D的原子半径比较:R(D)< R(C)(填“>”或“<”)
(6)E的最简单氢化物的化学式CH4.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(1)化学性质最不活泼的元素是Ar
(2)这9中元素中金属性最强的是K
(3)A在F中燃烧得到产物的化学式Na2O2
(4)G的最高价含氧酸的化学式是HCl04
(5)C与D的原子半径比较:R(D)< R(C)(填“>”或“<”)
(6)E的最简单氢化物的化学式CH4.
19.电负性的大小也可以作为判断元素金属性和非金属性强弱的尺度.下列关于电负性的变化规律正确的是( )
| A. | 周期表从左到右,元素的电负性逐渐变大 | |
| B. | 周期表从上到下,元素的电负性逐渐变大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |

 .
.