题目内容
10.下列各组离子能共存的是( )| A. | Na+、OH-、Al3+、SO42- | B. | Fe3+、SCN-、Na+、Cl- | ||
| C. | Mg2+、SO42-、Na+、Cl- | D. | H+、Cl-、NO3-、Fe2+ |
分析 根据离子之间不能结合生成沉淀、水、气体等,不能发生氧化还原反应等,离子大量共存,以此来解答.
解答 解:A.OH-、Al3+结合生成沉淀,不能大量共存,故A错误;
B.Fe3+、SCN-结合生成络离子,不能大量共存,故B错误;
C.该组离子之间不反应,可大量共存,故C正确;
D.H+、NO3-、Fe2+发生氧化还原反应,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、络合反应、氧化还原反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
6.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 4.6gNO2和N2O4的混合气体中氧原子数小于0.2NA | |
| B. | 1 L 0.1 mol.L-1的Na2S溶液中离子总数小于0.3NA | |
| C. | 在标况下,2.24 L CCl4含有0.4NA个Cl原子 | |
| D. | 0.1 mol H2O2参加氧化还原反应时,不一定转移0.2NA个电子 |
1.已知aXm+和bYn-两种离子的电子层结构相同,则a等于( )
| A. | b+m+n | B. | b+m-n | C. | b-m+n | D. | b-m-n |
18.下表列出了A~R9种元素在周期表中的位置
用元素符号填写下空:
(1)化学性质最不活泼的元素是Ar
(2)这9中元素中金属性最强的是K
(3)A在F中燃烧得到产物的化学式Na2O2
(4)G的最高价含氧酸的化学式是HCl04
(5)C与D的原子半径比较:R(D)< R(C)(填“>”或“<”)
(6)E的最简单氢化物的化学式CH4.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(1)化学性质最不活泼的元素是Ar
(2)这9中元素中金属性最强的是K
(3)A在F中燃烧得到产物的化学式Na2O2
(4)G的最高价含氧酸的化学式是HCl04
(5)C与D的原子半径比较:R(D)< R(C)(填“>”或“<”)
(6)E的最简单氢化物的化学式CH4.
5. 质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
 质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种.如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是( )| A. | 溶液中H+透过质子交换膜从右向左迁移 | |
| B. | 正极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 电子从a极流出经电解质溶液流到b极 | |
| D. | 该电池在使用过程中,H+的物质的量保持不变 |
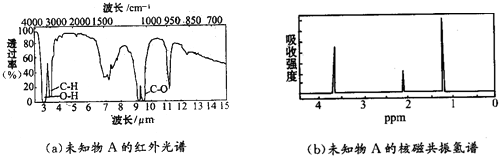
2.下列说法正确的是( )
| A. | 人们常借助元素分析仪来确定有机化合物的组成 | |
| B. | 有机化合物的核磁共振氢谱可以帮助我们确定物质中氢原子的种类 | |
| C. | 根据对红外光谱的分析,可以初步判定该有机物中碳原子的种类 | |
| D. | 用质谱法对有机物进行分析,可以初步判断该有机物中具有哪些基团 |
19.电负性的大小也可以作为判断元素金属性和非金属性强弱的尺度.下列关于电负性的变化规律正确的是( )
| A. | 周期表从左到右,元素的电负性逐渐变大 | |
| B. | 周期表从上到下,元素的电负性逐渐变大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
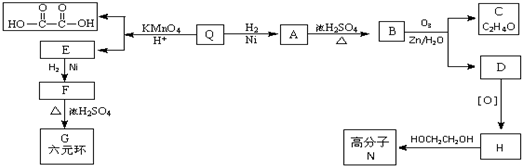
 ;Q的反式结构简式是
;Q的反式结构简式是 .
. .
.