题目内容
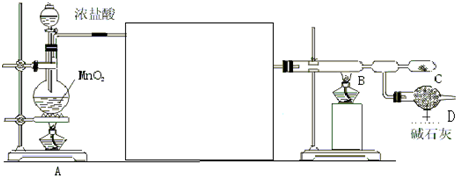
16.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效消毒剂.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定;②气体B能使湿润的红色石蕊试纸变蓝.(提示:NCl3中N为-3价).
回答下列问题:
(1)气体A的化学式为H2.
(2)电解时,发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3.为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②控制好反应的温度.
(3)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑.
(4)实验室制取气体B的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
分析 (1)电解NH4Cl、盐酸的溶液,氢离子放电生成氢气;
(2)电解时铵根离子失去电子,氢离子得到电子;结合信息可知NCl3防止分解及爆炸;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气.
解答 解:(1)电解NH4Cl、盐酸的溶液,氢离子放电生成氢气,则A为H2,故答案为:H2;
(2)电解时铵根离子失去电子,氢离子得到电子,电解反应为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3,结合信息可知NCl3防止分解及爆炸,则还应控制好反应的温度,
故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3;控制好反应的温度;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑,
故答案为:NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气,该反应为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查物质的制备,明确流程中发生的电解反应及氧化还原反应是解答本题的关键,题目难度较大,注意信息的应用及流程的分析,(3)为解答的难点.

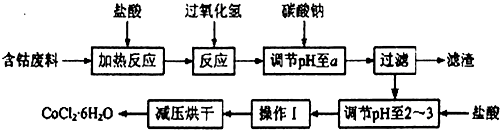
已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,)
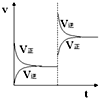 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )| A. | 正反应是吸热反应 | B. | 逆反应是吸热反应 | ||
| C. | m+n>p+q | D. | m+n<p+q |


 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: