题目内容
1.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
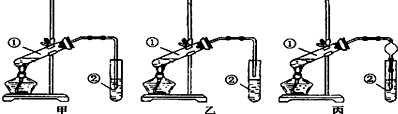
若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,不宜选择的装置是乙(填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是防止倒吸.
【实验步骤】
A.按所选择的装置组装仪器,在试管①中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是在试管①中加入3mL的乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸.然后轻轻地振荡试管,使之混合均匀.
B. 将试管固定在铁架台上;
C. 在试管②中加入5mL X试剂;
D. 用酒精灯对试管①加热
E. 当观察到试管②中有明显现象时停止实验.
【问题讨论】(1)实验中浓硫酸的作用是催化、吸水.
(2)试管②中加入的X试剂为饱和碳酸钠溶液,其作用是降低酯在水中的溶解度,除去酯中混有的酸和醇,使其容易分层
(3)步骤E试管②中观察到的现象是液面上有透明的不溶于水的油状液体产生,并可以闻到香味.
(4)进行该实验时,最好向试管①中加入几块碎瓷片,其目的是防止暴沸.
分析 本题是探究实验室制制取乙酸乙酯,涉及类似于浓硫酸稀释一样配制反应混合液,为了防止暴沸需要添加碎瓷片,实验中浓硫酸的作用,以及实验现象和反应后产物的分离提纯,可据此分析作答;
【装置设计】装置中②的导管不能伸入液面以下,否则容易发生倒吸现象,则装置甲会发生倒吸现象,装置乙合理;丙中球形干燥管还可以防止倒吸;
【实验步骤】混合溶液的配制一般是密度大的加到密度小的液体里,可参考浓硫酸的稀释方法来配制混合溶液;
(1)浓硫酸有吸水性且做催化剂加快反应速率;
(2)饱和碳酸钠溶液能够除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
(3)乙酸乙酯不溶于饱和碳酸钠溶液,所以试管②中混合液分层,上层为有油状液体;
(4)液体混合物加热时需要防暴沸,添加碎瓷片可达到目的.
解答 解:【装置设计】乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,故答案为:乙;防止倒吸;
【实验步骤】在试管①中先加入3mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸,故答案为:在试管①中加入3mL的乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸;
(1)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂,故答案为:催化、吸水;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,故答案为:饱和碳酸钠溶液;降低酯在水中的溶解度,除去酯中混有的酸和醇,使其容易分层;
(3)乙酸乙酯在饱和碳酸钠溶液的溶解度较小,所以会过程中试管②中液体分为两层(有水果味),故答案为:液面上有透明的不溶于水的油状液体产生,并可以闻到香味;
(4)为防止液体混合物加热,需要加碎瓷片,故答案为:防止暴沸.
点评 本题考查了乙酸乙酯的反应原理及实验室制法,题目难度不大,注意掌握乙酸乙酯的制备方法及反应原理,明确饱和碳酸钠溶液、浓硫酸在实验中的作用为解答本题的关键.


产物的有关数据如表所示:
| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
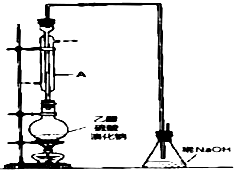
冬青油是一种无色液体,某实验小组利用如图所示的装置制备冬青油.化学反应原理和实验装置如下所示:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.


pH值控制可参考下列数据
| 物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
(1)A物质可选用b(填字母).
a.稀H2SO4b.浓H2SO4/△c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的将Fe2+氧化为Fe3+.
(3)Ⅱ中加Cu2(OH)2CO3的目的是中和过量的硫酸,调节溶液的pH,使Fe3+水解完全而沉淀;其优点是不引入新的杂质.
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+.
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解.
(6)V到Ⅵ的操作是蒸发浓缩,冷却结晶,过滤
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是会产生SO2,会对污染环境,硫酸的利用率低.如何改进可以向稀硫酸中不断通氧气(或者加H2O2)并加热.
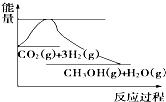 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H>0,△S>0 | D. | △H<0,△S>0 |
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O

