题目内容
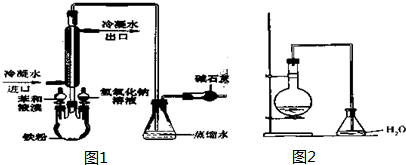
7.黄铜矿的主要成分是CuFeS2(硫元素显-2价,铁元素显+2价).实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如图1:

已知:CuFeS2+O2$\frac{\underline{\;高温\;}}{\;}$Cu+FeS+SO2;FeS+2HC1=FeC12+H2S↑
(1)在实验室中,应将黄铜矿粉末放在坩埚(填仪器名称)中焙烧.
(2)将反应过程中产生的SO2和H2S通入如图2所示装置中检验它
们的性质.该实验证明SO2具有漂白性和氧化性.
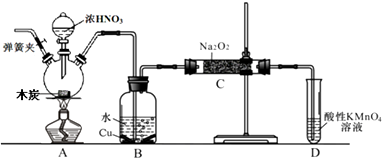
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气.

①圆底烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑2H2O.
②按气流方向由左到右,导管口连接顺序为a→b→c→g→h→d.
③装置连接好后,需要进行的操作是检查装置的气密性.
(4)若铁红Fe2O3样品中含有FeO,选用提供的试剂,设计实验验证铁红中含有FeO.写出有关实验操作、现象与结论.取少量固体样品于试管中,加稀硫酸溶解,向溶液中滴加少量KMnO4溶液,若KMnO4溶液紫红色褪色,则证明含有FeO.
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水.
分析 本题是实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程,涉及SO2的氧化性和还原性的检验,装置的连接及气密性的检验,还探究了如何证明铁红Fe2O3样品中含有FeO的实验设计,可借鉴Fe3+的检验及Fe2+与Fe3+的转化来实验,据此解答;
(1)固体的焙烧在坩埚内进行;
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性;
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O.离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑2H2O;
②生成的Cl2含有HCl、H2O,所以a连接b、c,通过饱和食盐水除去HCl、继续连接g、h,通过浓硫酸,除去H2O,再连接d,即可收集纯净、干燥的氯气;
③装置连接好后,在装药品前,需检验装置的气密性;
④固体中是否含有FeO,需要先用稀硫酸溶解形成溶液,再证明溶液里有没有Fe2+,Fe2+的检验可以借助于Fe3+的检验进行,可以先证明溶液里没有Fe3+,再添加氧化剂氯水后,证明溶液里有Fe3+,从而推出溶液里有Fe2+.
解答 解:(1)固体的焙烧在坩埚内进行;故答案为:坩埚;
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性,故答案为:漂白;氧化;
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O.离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑2H2O;
②生成的Cl2含有HCl、H2O,所以a连接b、c,通过饱和食盐水除去HCl、继续连接g、h,通过浓硫酸,除去H2O,再连接d,即可收集纯净、干燥的氯气;故答案为:b→c→g→h→d;
③整套装置涉及气体的制备与性质检验,因此添加药品前,需要检验装置气密性,故答案为:检查装置的气密性;
④欲证明铁红Fe2O3样品中含有FeO,可以取少量固体样品于试管中,加稀硫酸溶解,向溶液中滴加少量KMnO4溶液,若KMnO4溶液紫红色褪色,则证明含有FeO,故答案为:取少量固体样品于试管中,加稀硫酸溶解,向溶液中滴加少量KMnO4溶液,若KMnO4溶液紫红色褪色,则证明含有FeO.
点评 本题考查了物质制备过程分析判断,物质性质的理解应用,化学方程式和离子方程式书写方法,掌握基础是关键,题目难度较大.

 名校课堂系列答案
名校课堂系列答案
 =BaSO4↓
=BaSO4↓ =CaCO3↓+CO
=CaCO3↓+CO +2H2O
+2H2O
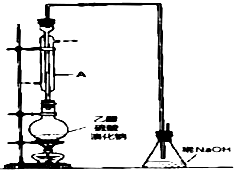 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O .
.