题目内容
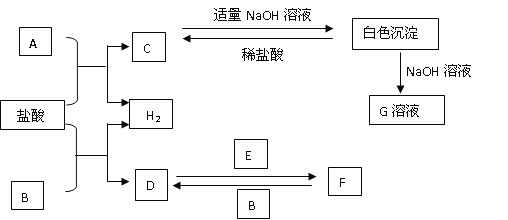
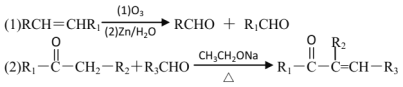
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是( )

A.实验I中溶液红色褪去,说明发生了反应H++OH-![]() H2O
H2O
B.实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中仍然存在大量的Na+与OH
C.实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应2H++SO42-+Ba2++2OH-= 2H2O+BaSO4↓
D.将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
【答案】D
【解析】
A. Ba(OH)2与盐酸发生中和反应:H++OH-![]() H2O,溶液红色褪去,故A正确;
H2O,溶液红色褪去,故A正确;
B. Na2SO4与Ba(OH)2溶液发生反应生成硫酸钡沉淀和氢氧化钠,实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH,故B正确;
C. H2SO4与Ba(OH)2溶液发生反应2H++SO42-+Ba2++2OH—= 2H2O+BaSO4↓,溶液碱性减弱,导电离子浓度减小,则实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,故C正确;
D. 将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,发生反应![]() ,有蓝色沉淀生成,溶液红色褪去,灯泡逐渐变暗,反应现象与原实验Ⅱ中的现象不同,故D错误;
,有蓝色沉淀生成,溶液红色褪去,灯泡逐渐变暗,反应现象与原实验Ⅱ中的现象不同,故D错误;
故选D。

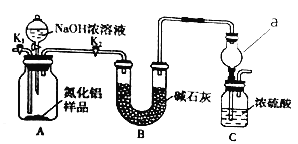
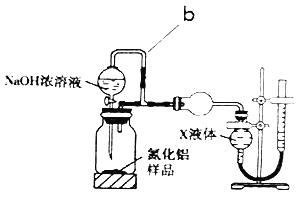
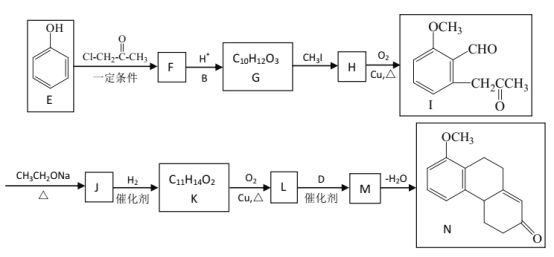
【题目】为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的![]() 质量进行计算.某同学设计的实验装置示意图如下:
质量进行计算.某同学设计的实验装置示意图如下:

请回答:
(1)A中发生反应的化学方程式是__________________________。
(2)装置B中冰水的作用是_________________________。
(3)该同学设计的实验装置存在缺陷,改进后该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是________________(填字母)。
A.样品分解不完全
B.产生![]() 的速率太快,没有被碱石灰完全吸收
的速率太快,没有被碱石灰完全吸收
C.反应完全后停止加热,通入过量的空气.
(4)若C中的碱石灰改用足量![]() 固体,请设计实验方案检验反应后C中固体的成分___________。
固体,请设计实验方案检验反应后C中固体的成分___________。
(5)检验样品中是否还含有NaHCO3,请选择下列装置设计实验,并完成下表:

选择的装置(填编号) | 实验现象 | 实验结论 |
①_______________________________ | ②_________________ | 样品中含NaHCO3 |