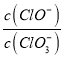题目内容
【题目】黄铜矿、辉铜矿、斑铜矿等是工业炼铜的常用原料。完成下列计算:
(1)某种黄铜矿中铜的质量分数为0.25,生产1吨纯铜理论上需要这种铜矿_______吨。
(2)实验室以黄铜矿为原料模拟工业炼铜时会产生SO2,用200 mL 1 mol/L的NaOH溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98 g,求所得固体的成分及物质的量。__________
(3)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40∶7。常温下将5.04 g M粉末全部溶于过量浓HNO3中,反应后的溶液加水稀释至500 mL,测得其pH=0。向溶液中滴加5 mol/L的NaOH溶液,当加入126 mL后,沉淀质量不再增加,求M的化学式。__________
(4)以辉铜矿为原料火法炼铜,其原理是:
2Cu2S+3O2 → 2Cu2O+2SO2; Cu2S+2Cu2O → 6Cu+SO2↑。
将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol,求所得气体中SO2的体积分数。__________
【答案】4吨 n(NaHSO3)=0.18 mol;n(Na2SO3)=0.01 mol Cu5FeS4(或FeCu5S4) 若Cu2S过量,SO2%=20%,若Cu2O过量,SO2%=16.7%。
【解析】
(1)根据元素守恒,矿石中铜的质量等于纯铜的质量计算;
(2)NaOH的物质的量n(NaOH)=1 mol/L×0.2 L=0.2 mol,假设固体全为Na2SO3,则其质量为m(Na2SO3)=![]() ×0.2 mol×126 g/mol=12.6 g<19.98 g;假设固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,故固体为Na2SO3、NaHSO3的混合物,根据钠离子守恒与二者总质量列方程计算各自物质的量;
×0.2 mol×126 g/mol=12.6 g<19.98 g;假设固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,故固体为Na2SO3、NaHSO3的混合物,根据钠离子守恒与二者总质量列方程计算各自物质的量;
(3)根据Cu、Fe元素的质量比为40:7计算n(Cu):n(Fe),当加水稀释至500 L时测得其pH为0,此时氢离子浓度为1 mol/L,氢氧化钠先中和氢离子,然后将金属离子转化为沉淀,此时根据元素守恒可计算消耗氢氧化钠的物质的量n(NaOH)=2n(Cu2+)+3n(Fe3+)+n(H+),联立可以计算n(Cu)、n(Fe),进而计算S元素物质的量,再计算三元素物质的量之比确定化学式;
(4)已知2Cu2S+3O2→2Cu2O+2SO2,Cu2S+2Cu2O→6Cu+SO2↑,反应得到单质铜3 mol,根据方程式计算生成二氧化硫,结合空气中氧气和氮气的含量计算。
(1)黄铜矿中铜的质量分数为0.25,则生产1吨纯铜,需矿石的质量m=1吨÷0.25=4吨;
(2)200 mL 1 mol/L的NaOH溶液中含NaOH的物质的量为n(NaOH)=1 mol/L×0.2 L=0.2 mol,根据Na元素守恒,用极值方法计算,假设反应后得到的固体全为Na2SO3,m(Na2SO3)=![]() ×0.2 mol×126 g/mol=12.6 g<19.98g;假设反应得到的固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,说明得到固体为Na2SO3、NaHSO3的混合物,设Na2SO3、NaHSO3的物质的量分别为x mol、y mol,则:由二者总质量:126x+104y=19.98
×0.2 mol×126 g/mol=12.6 g<19.98g;假设反应得到的固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,说明得到固体为Na2SO3、NaHSO3的混合物,设Na2SO3、NaHSO3的物质的量分别为x mol、y mol,则:由二者总质量:126x+104y=19.98
根据Na元素守恒:2x+y=0.2,解得x=0.01 mol,y=0.18 mol,所以最后所得固体中含有Na2SO3为0.01 mol,NaHSO3为0.18 mol;
(3)由斑铜矿Cu、Fe元素的质量比为40:7,可得二者的物质的量的比n(Cu):n(Fe)=![]() :
:![]() =5:1,当加水稀释至500 L时测得其pH为0,此时氢离子浓度为c(H+)=1 mol/L,向溶液中滴加5 mol/L的NaOH溶液,NaOH先中和溶液中H+,然后将Cu2+、Fe3+转化为Cu(OH)2、Fe(OH)3沉淀,所以根据Na元素守恒,当恰好形成沉淀时,溶液2n(Cu2+)+3n(Fe3+)=5 mol/L×0.126 L-1 mol/L×0.5 L=0.13 mol,两式联立解得:n(Cu)=0.05 mol,n(Fe)=0.01 mol,
=5:1,当加水稀释至500 L时测得其pH为0,此时氢离子浓度为c(H+)=1 mol/L,向溶液中滴加5 mol/L的NaOH溶液,NaOH先中和溶液中H+,然后将Cu2+、Fe3+转化为Cu(OH)2、Fe(OH)3沉淀,所以根据Na元素守恒,当恰好形成沉淀时,溶液2n(Cu2+)+3n(Fe3+)=5 mol/L×0.126 L-1 mol/L×0.5 L=0.13 mol,两式联立解得:n(Cu)=0.05 mol,n(Fe)=0.01 mol,
故斑铜矿中S元素的质量m(S)=5.04 g-0.01 mol×56 g/mol-0.05 mol×64 g/mol=1.28 g,则n(S)=![]() =0.04 mol,n(Fe):n(Cu): n(S)= 0.01 mol:0.05 mol:0.04mol=1:5:4,所以M的化学式为FeCu5S4;
=0.04 mol,n(Fe):n(Cu): n(S)= 0.01 mol:0.05 mol:0.04mol=1:5:4,所以M的化学式为FeCu5S4;
(4)将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol。
若Cu2S过量,由2Cu2S+3O2→2Cu2O+2SO2可知1 mol Cu2S反应会消耗1.5 mol O2,反应产生1 mol Cu2O![]() ×100%=20%;
×100%=20%;
若Cu2O过量,由Cu2S+2Cu2O→6Cu+SO2↑可知反应产生3 mol Cu,会同时产生0.5 mol SO2,反应消耗0.5 mol Cu2S和1 mol Cu2O,发生2Cu2S+3O2→2Cu2O+2SO2的Cu2S为2.5 mol,反应消耗3.75 mol O2,同时得到2.5 mol Cu2O和2.5 mol SO2,反应消耗氧气为3.75 mol,氮气的物质的量是氧气的4倍,则氮气的物质的量为3.75 mol ×4=15 mol,共生成的SO2为0.5 mol+2.5 mol=3 mol,则所得气体中的SO2的体积分数为:![]() ×100%=16.7%。
×100%=16.7%。

【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
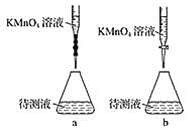
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。
(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果____________(偏大、偏小或没有影响) 。