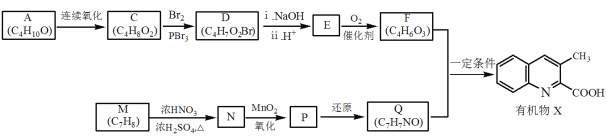
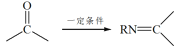
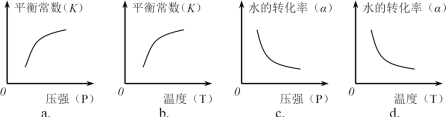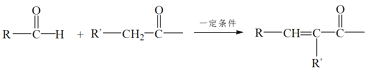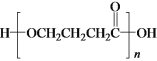题目内容
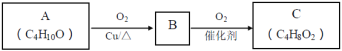
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1 mol时,下列说法正确的是( )

A.溶液的质量变化:甲减小乙增大
B.溶液pH值变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极:Cu2++2e﹣=Cu,乙中负极:Mg﹣2e﹣=Mg2+
【答案】A
【解析】
A. 甲中总反应为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,乙中总反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故甲溶液质量减小,乙溶液质量增大,故A正确;
2Cu+2H2SO4+O2↑,乙中总反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故甲溶液质量减小,乙溶液质量增大,故A正确;
B. 甲中生成H2SO4,pH减小,乙中消耗NaOH,pH减小,故B错误;
C. 当两装置电路中通过的电子都是0.1mol时,甲中产生0.025molO2,乙中产生0.05molH2,故相同条件下,甲乙中产生气体的体积比为1:2,故C错误;
D. 甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Al放电,电极反应为:Al-3e-+4OH-=AlO2-+2H2O,故D错误;
正确答案是A。

【题目】苯乙烯是一种重要的化工原料,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,苯乙烯在2B类致癌物清单中。
(1)工业上可用乙苯催化脱氢方法制备苯乙烯,其反应原理如下:
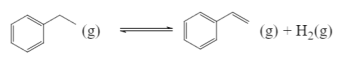
①在容积固定为2L的密闭容器内充人2mol![]() ,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 12.6 | 13.68 | 14.55 | 15.22 | 15.6 | 15.75 | 15.75 |
根据表中数据计算该温度下压强平衡常数Kp_____(计算结果带单位,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应)。在一定压强、900K的条件下,苯乙烯的产率随着![]() 的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
(2)研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛(结构简式为![]() ),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
【题目】I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是___________;其与水反应的化学方程式为______________________。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为____________。氧原子的核外电子排布式为_________________。
(3)与同主族元素Mg相比,Ca的金属性更______(填“强”或者“弱”)。能证明这一结论的实验事实是________________________。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g)。完成下列填空:
CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是____________。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | C | H2 | CO | |||
1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为____________。
②下列图像正确的是________。(选填编号)