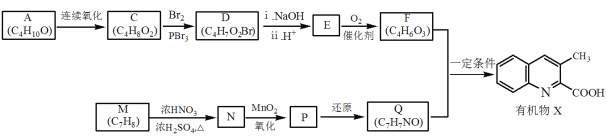
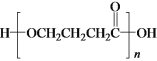题目内容
【题目】Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气。完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在____个平衡。
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:___________________。当消耗标况下22.4升富氧空气时,有________mol电子转移。
(3)H2来自于天然气:CH4(g)+ H2O(g)![]() 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”、“碱”或“中”)性;amol/LNH4Cl与a mol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序:___________。
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中___________。 (选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:__________________________。
【答案】4 2NH4HS+O2→2 NH3·H2O+2S↓ 2 ad 中 c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+) cd 饱和碳酸溶液中电离出的碳酸根离子很少,所以没有沉淀,加入氨水后促进碳酸电离,碳酸根离子浓度增大,产生沉淀
【解析】
Ⅰ(1)H2S电离产生氢离子和硫氢根离子、硫氢根离子电离产生氢离子和硫离子、氨水电离产生铵根离子和氢氧根离子、水电离产生氢离子的氢氧根离子;
(2)NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫,所以反应方程式为:2NH4HS+O2═2NH3H2O+2S↓;当消耗标况下22.4升富氧空气时氧气的体积为11.2L,所以氧气的物质的量为0.5mol;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
Ⅱ(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性;amol/LNH4Cl与amol/L氨水等体积混合(pH>7),说明氨水的电离为主,溶液呈碱性,所以判断离子浓度大小关系;
(5)a.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;
b.正好生成CH3COONH4时,醋酸根和铵根离子水解对水的电离起促进作用,所以与纯水中H2O的电离程度不相同;
c.常温下等浓度的NH4Cl和CH3COONa两溶液的,水解程度相同,而氯化铵水解呈酸性,醋酸钠水解呈碱性,所以pH之和为14;
d.CH3COOH和NH3H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒可知c(NH4+)=c(CH3COO-);
(6)通入一定量的NH3后使溶液呈碱性,能够生成NH4Cl,饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀.加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生。
(1)H2S电离产生氢离子和硫氢根离子、硫氢根离子电离产生氢离子和硫离子、氨水电离产生铵根离子和氢氧根离子、水电离产生氢离子的氢氧根离子,所以存在4个平衡; (2)NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫,所以反应方程式为:2NH4HS+O2═2NH3H2O+2S↓,当消耗标况下22.4升富氧空气时氧气的体积为11.2L,所以氧气的物质的量为0.5mol,所以转移电子数为:0.5mol×4=2mol;
(3)a.υ正(H2):υ逆(CO)=3:1,正反应和逆反应速率相等,达平衡状态,故a正确;
b.由于是恒容,密度等于质量除以体积,故气体密度一直不变,故b错误;
c.c(H2):c(CO)=3:1,而不是不变,故c错误;
d.气体的平均相对分子质量保持不变,说明气体的物质的量不变,达平衡状态,故d正确;
答案选:ad;
Ⅱ(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl)=0.005mol/L,根据物料守恒得c(NH3·H2O)=(0.5a0.005)mol/L,根据电荷守恒得c(H+)=c(OH)=107mol/L,溶液呈中性,amol/LNH4Cl与amol/L氨水等体积混合(pH>7),说明氨水的电离为主,溶液呈碱性,所以离子浓度大小为:c(NH4+)>c(Cl)>c(NH3H2O)>c(OH)>c(H+);
(5)a.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故a错误;
b.正好生成CH3COONH4时,醋酸根和铵根离子水解对水的电离起促进作用,所以与纯水中H2O的电离程度不相同,故b错误;
c.常温下等浓度的NH4Cl和CH3COONa两溶液的,水解程度相同,而氯化铵水解呈酸性,醋酸钠水解呈碱性,所以pH之和为14,故c正确;
d.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH),根据电荷守恒可知:c(NH4+)=c(CH3COO),故d正确;
答案选cd;
(3)通入一定量的NH3后使溶液呈碱性,能够生成NH4Cl,饱和H2CO3溶液中电离产生的CO32很少,因此没有沉淀。加入氨水后,促进H2CO3的电离,CO32离子浓度增大,有沉淀产生。

 阅读快车系列答案
阅读快车系列答案【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O电子式为____________。
(2)下列能判断Cl和O两种元素非金属性强弱的是______(选填编号)。
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是________,氧化产物________。(填离子符号)