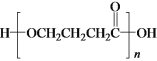题目内容
【题目】实验室需配制![]()
![]()
![]() 溶液,下列说法不正确的是
溶液,下列说法不正确的是
A.应用托盘天平称取![]() 晶体
晶体![]()
B.配制操作必需的玻璃仪器是烧杯、玻璃棒、胶头滴管、500mL容量瓶
C.采用加热来加快![]() 晶体的溶解,需趁热迅速将溶液转移至容量瓶中
晶体的溶解,需趁热迅速将溶液转移至容量瓶中
D.定容摇匀后发现溶液液面低于刻度线,不需要再滴加蒸馏水至刻度线
【答案】C
【解析】
配制![]()
![]()
![]() 溶液,要用500mL的容量瓶,计算称量固体质量时也需要按照500mL进行计算。
溶液,要用500mL的容量瓶,计算称量固体质量时也需要按照500mL进行计算。
A.配制![]()
![]()
![]() 溶液,要用500mL的容量瓶,计算称量固体质量时也需要按照500mL进行计算,则需要称取
溶液,要用500mL的容量瓶,计算称量固体质量时也需要按照500mL进行计算,则需要称取![]() 晶体的质量为0.5L
晶体的质量为0.5L![]() 0.1mol/L
0.1mol/L![]() 286g/mol=14.3g,故A正确;
286g/mol=14.3g,故A正确;
B.配制操作中溶解时要用到烧杯、玻璃棒,移液时要用到500mL容量瓶,定容时要用到胶头滴管,故B正确;
C.容量瓶的使用有温度要求,溶液必须冷却到室温才能转移到容量瓶中,故C错误;
D.定容摇匀后发现溶液液面低于刻度线,是因为部分液体残留在刻度线上方,不需要再滴加蒸馏水至刻度线,故D正确;
故答案选C。

 期末1卷素质教育评估卷系列答案
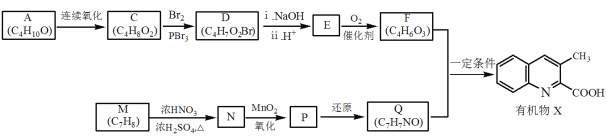
期末1卷素质教育评估卷系列答案【题目】苯乙烯是一种重要的化工原料,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,苯乙烯在2B类致癌物清单中。
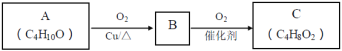
(1)工业上可用乙苯催化脱氢方法制备苯乙烯,其反应原理如下:
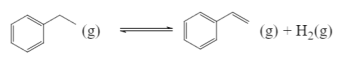
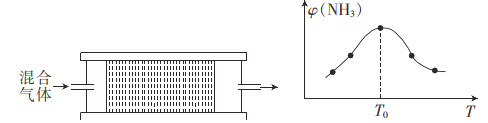
①在容积固定为2L的密闭容器内充人2mol![]() ,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 12.6 | 13.68 | 14.55 | 15.22 | 15.6 | 15.75 | 15.75 |
根据表中数据计算该温度下压强平衡常数Kp_____(计算结果带单位,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应)。在一定压强、900K的条件下,苯乙烯的产率随着![]() 的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
(2)研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛(结构简式为![]() ),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
【题目】在高中阶段,安排了两种酯的制备实验:
乙酸乙酯的制备
乙酸丁酯[CH3COO(CH2)3CH3]的制备
制备这两种酯所涉及的有关物质的物理性质见下表:
乙酸 | 乙醇 | 1—丁醇 | 乙酸乙酯 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -117.3 | -89.5 | -83.6 | -73.5 |
沸点(℃) | 117.9 | 78.5 | 117 | 77.06 | 126.3 |
密度(g/cm3) | 1.05 | 0.79 | 0.81 | 0.90 | 0.88 |
水溶性 | 互溶 | 互溶 | 可溶 (9g/100克水) | 可溶 (8.5g/100克水) | 微溶 |
请回答下列问题:
(1)在乙酸乙酯的制备过程中,采用水浴加热的优点为_______________________;而乙酸丁酯的制备过程中未采用水浴加热的原因是______________。
(2)提纯时,乙酸乙酯一般采用______洗涤,而乙酸丁酯可先采用______、后采用______洗涤(均填编号)。
a.水 b.15%Na2CO3溶液 c.饱和Na2CO3溶液
(3)两种酯的提纯过程中都需用到的关键仪器是______________,在操作中要注意振荡洗涤后,静置分液前必须要有步骤,所制得的酯应从该仪器的________(填编号)。
a.下部流出 b.上口倒出 c.都可以
(4)在乙酸乙酯制备中,采用了乙醇量,下列说法不正确的是_______(填编号)。
a.乙醇比乙酸价廉 b.提高乙酸的转化率
c.提高乙醇的转化率 d.提高乙酸乙酯的产率
(5)在乙酸丁酯制备中,下列方法可提高1—丁醇利用率的是________(填编号)。
a.使用催化剂 b.加过量乙酸 c.不断移去产物 d.缩短反应时间
【题目】某同学进行SO2的性质实验。在点滴板a、b、c、d处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。下列说法正确的是( )
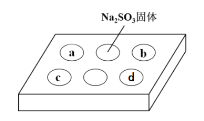
序号 | 试剂 | 实验现象 |
a | 品红溶液 | 红色褪去 |
b | 酸性KMnO4溶液 | 紫色褪去 |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
d | H2S溶液 | 黄色浑浊 |
A.在浓硫酸与Na2SO3固体反应中,浓硫酸表现的强氧化性
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+2OH-=SO32-+H2O
D.d中表明SO2具有氧化性