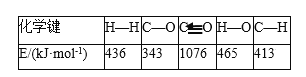
题目内容
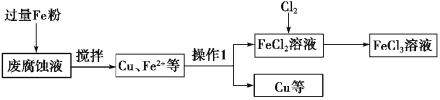
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体的工艺流程如下:
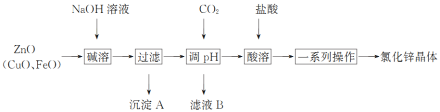
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22—。
(1)“调pH”步骤中通入过量CO2时发生反应的化学方程式为________;“酸溶”时发生反应的离子方程式为___________。
(2)下列说法不正确的是_______。
A 加入过量NaOH溶液的目的是提高锌元素的浸取率
B 沉淀A的主要成分是CuO、FeO
C 洗涤沉淀时,直接将洗涤剂加入漏斗,并用玻璃棒轻轻搅拌
D 利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)流程中需进行蒸发浓缩,在实验室中进行蒸发浓缩的具体操作是_____。
(4)氯化锌晶体是白色晶体,可含1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是SOCl2(SOCl2熔点为105 ℃、沸点为78.8 ℃、遇水剧烈水解生成两种酸性气体)。
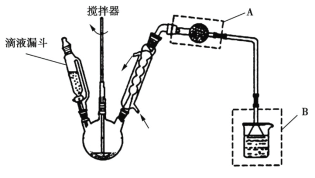
①下列物质中最适合洗涤氯化锌晶体的是_________。
A 冷水 B 浓盐酸 C 乙醇 D 氨水
②仪器A的名称为_______;装置B的作用是_________。
③以ZnCl2·H2O为例,写出三颈烧瓶中发生反应的化学方程式_______。
【答案】2CO2+2H2O+Na2ZnO2=Zn(OH)2↓+2NaHCO3 Zn(OH)2+2H+=Zn2++2H2O C 将溶液转移至蒸发皿中,控制温度加热至溶液表面形成一层晶膜 B 球形干燥管 吸收HCl和SO2,防止倒吸 ZnCl2·H2O+SOCl2=ZnCl2+2HCl↑+SO2↑
【解析】
本题主要考查考生对实验化学相关知识与技能的掌握,意在考查考生的实验能力及分析、判断能力。(1)“调pH”步骤中通入过量CO2时,CO2与Na2ZnO2反应生成Zn(OH)2沉淀和NaHCO3;“酸溶”时,氢氧化锌被盐酸溶解生成氯化锌和水,氢氧化锌难溶于水,在离子方程式中用化学式表示。
(2)选项A,加入过量NaOH溶液能使氧化锌完全溶解,从而提高锌元素的浸取率,正确;选项B,CuO、FeO为碱性氧化物,不能与氢氧化钠溶液反应,所以沉淀A的主要成分是CuO、FeO,正确;选项C,洗涤沉淀时,不能用玻璃棒搅拌,否则会破坏滤纸,错误;选项D,从氯化锌溶液中获得氯化锌晶体主要包括蒸发浓缩、冷却结晶、抽滤等步骤,故可采用结晶法获得氯化锌晶体,正确。故选C。(3)实验室中蒸发浓缩在蒸发皿中进行,加热至溶液表面形成一层晶膜即可。(4)①选项A,氯化锌晶体易溶于水,不能用冷水洗涤,错误;选项B,氯化锌晶体会水解,用浓盐酸洗涤能抑制其水解,同时减少溶解损失,正确;选项C,氯化锌晶体能溶于乙醇,不能用乙醇洗涤,错误;选项D,氯化锌晶体与氨水能发生反应,不能用氨水洗涤,错误。②仪器A为球形干燥管,仪器B中有倒置的漏斗,可以使吸收氯化氢和二氧化硫更充分,且能防止倒吸。③SOCl2利用遇水剧烈水解生成两种酸性气体的性质分析,ZnCl2·H2O和SOCl2反应生成无水氯化锌和盐酸和二氧化硫,方程式为:ZnCl2·H2O+SOCl2=ZnCl2+2HCl↑+SO2↑。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案