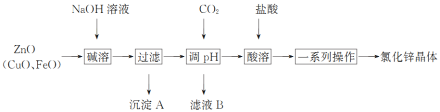
题目内容
【题目】随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_____________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有___,CH3OH的熔、沸点比CH4高,其主要原因是__________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
【答案】[Ar]3d64s2 N2; CN-; ![]() C≡O CH4、CH3OH CH3OH分子是极性分子,同时分子之间还存在着氢键的作用 sp3 sp2
C≡O CH4、CH3OH CH3OH分子是极性分子,同时分子之间还存在着氢键的作用 sp3 sp2
【解析】
(1)Fe的原子序数为26,利用电子排布规律来书写电子排布式;
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键,等电子体中原子数和价电子数都相同;
(3)判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式;氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间相互作用,称为氢键;
(4)判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式.
(1)Fe的原子序数为26,则基态电子排布式为[Ar]3d64s2,
故答案为:[Ar]3d64s2;
(2)等电子体中原子数和价电子数都相同,则N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,所以其中分子为:N2,离子为:CN-;互为等电子体的分子结构相似,根据氮气的结构式与电子式可知,CO分子结构式为C≡O,电子式为:![]() ,
,
故答案为:N2;CN-;![]() ;C≡O;
;C≡O;
(3)在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化;在CH3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化;CH4分子中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化。CH3OH分子是极性分子,且CH3OH形成分子间氢键,沸点较CH4高,
故答案为:CH4、CH3OH;CH3OH分子是极性分子,同时分子之间还存在着氢键的作用;
(4)价层电子对数=σ键电子对数+中心原子上的孤电子对数,-CH3中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0)所以碳原子采用sp3;-CHO价层电子对数=σ键电子对数(3)+中心原子上的孤电子对数(0),所以碳原子采用sp3。
故答案为:sp3;sp2。

【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度