题目内容
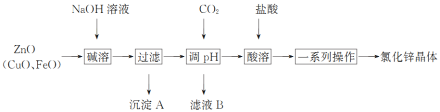
【题目】实验室利用印刷电路的废腐蚀液(含有大量CuCl2、FeCl2和FeCl3)回收Cu,主要流程如下:
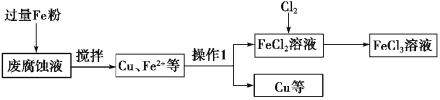
(1)操作1的名称是__________,需要用到的玻璃仪器有________________________。
(2)加入过量铁粉发生的离子反应有_______________。
(3)获得的铜粉中含有杂质,除杂所需的试剂是_______________(填化学式)。
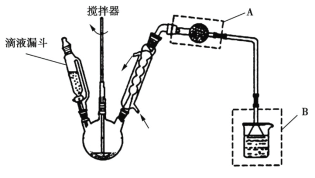
(4)实验室利用如图所示装置制取一定量的FeCl3。
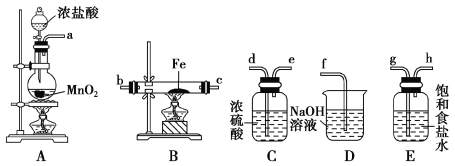
各装置的正确连接顺序为(填写装置代号)A→______→______→______→D。装置C的作用是____________________________,写出装置D中反应的离子方程式:_________________。
【答案】过滤 漏斗、玻璃棒、烧杯 Fe+2Fe3+===3Fe2+、Fe+Cu2+===Fe2++Cu 稀HCl或稀H2SO4 E C B 干燥Cl2,防止FeCl3水解 Cl2+2OH-===Cl-+ClO-+H2O
【解析】
(1)操作1的名称是过滤,需要用到的玻璃仪器有漏斗、玻璃棒、烧杯。本小题答案为:过滤;漏斗、玻璃棒、烧杯。
(2)加入过量铁粉,Fe与Fe3+、Cu2+发生反应,离子方程式为Fe+2Fe3+===3Fe2+、Fe+Cu2+===Fe2++Cu。本小题答案为:Fe+2Fe3+===3Fe2+、Fe+Cu2+===Fe2++Cu。
(3)获得的铜粉中含有Fe,可以加入稀盐酸或稀硫酸除去Fe。本小题答案为:稀HCl或稀H2SO4。
(4)制取的氯气中含有HCl、H2O,先通过E除去HCl,再通过C除去H2O,后通过B与Fe反应,D的作用是除去过量的氯气。本小题答案为:E;C;B;干燥Cl2,防止FeCl3水解;Cl2+2OH-===Cl-+ClO-+H2O。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案