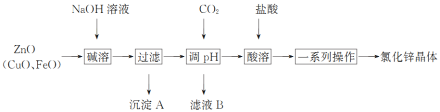
题目内容
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)向A、B溶液中分别滴入几滴KSCN溶液, A溶液颜色:________B溶液颜色_______。
(2)写出上述过程中有关反应的离子方程式:A→B___________________。若有2mol的A参与该反应,则转移______mol电子。A作_____剂
(3)B→C(暴露在空气中)可看到的现象是__________________________________。
(4)将A的饱和溶液制成胶体的操作______________________;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
【答案】血红色 浅绿色 2Fe3+ + Fe = 3 Fe2+ 2 氧化 白色沉淀迅速转化为灰绿色最终转化为红褐色 将FeCl3饱和溶液滴入沸水中,继续加热至溶液呈红褐色,停止加热 丁达尔
【解析】
氧化铁被盐酸溶解生成氯化铁,氯化铁与铁粉反应生成氯化亚铁,氯化亚铁溶液中加入氢氧化钠溶液反应生成氢氧化亚铁白色沉淀,迅速变成灰绿色,最终变成红褐色。据此分析解答。
(1)氧化铁和盐酸反应生成三价铁盐和水,三价铁离子遇到硫氰酸钾显示血红色;金属铁可以和三价铁化和生成亚铁离子,亚铁离子遇到硫氰酸钾不变色,故答案为:血红色;浅绿色;
(2)氯化铁与Fe反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe=3Fe3+,反应中Fe3+由+3价变成+2价,化合价降低,被还原,氯化铁是氧化剂,若有2mol的氯化铁参与反应,则转移2mol电子,故答案为:2Fe3++Fe=3Fe3+;2;氧化;
(3)氯化亚铁与NaOH生成的C为氢氧化亚铁,易被氧化生成氢氧化铁,则C在空气中发生变化的现象为白色沉淀迅速变为灰绿色,最后变为红褐色,故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色;
(4)将氯化铁滴入沸水中,继续加热至溶液呈红褐色,停止加热,可以获得氢氧化铁胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为丁达尔效应,故答案为:将FeCl3饱和溶液滴入沸水中,继续加热至溶液呈红褐色,停止加热;丁达尔。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案