题目内容
【题目】某铝土矿主要含Al2O3。某课题组以此为原料回收氧化铝,设计实验流程如下:
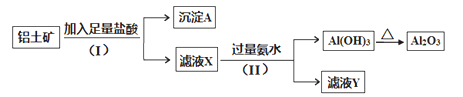
(1)步骤(I)中分离溶液和沉淀的操作名称是______,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是______________。
(2)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式_______________________________。
(3)实验室里用NaAlO2 溶液制取Al(OH)3最好选用________(填序号)。
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(4)取54g铝土矿进行实验,最后得到氧化铝51g,则该铝土矿中铝的含量为______(假设实验过程没有损失)。
【答案】过滤 漏斗 Al 3+ +3NH3·H2O= Al(OH)3+3NH4+ C 50﹪
【解析】
由流程可知,铝土矿中加足量盐酸,氧化铝被溶解,过滤得到沉淀A为SiO2,滤液X中含Al3+,滤液X中加过量氨水反应生成氢氧化铝沉淀和氯化铵,过滤得到沉淀Al(OH)3,氢氧化铝加热分解生成氧化铝和水,滤液Y为氯化铵溶液,据此分析解答。
(1)步骤(I)中分离溶液和沉淀的操作是过滤,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是漏斗,故答案为:过滤;漏斗;
(2)步骤(Ⅱ)中生成Al(OH)3的反应是氯化铝溶液中铝离子和氨水反应生成氢氧化铝沉淀和氯化铵,反应的离子方程式为Al3++3NH3H2O═Al(OH)3↓+3NH4+,故答案为:Al3++3NH3H2O═Al(OH)3↓+3NH4+;
(3)氢氧化铝是两性氢氧化物,易溶于氢氧化钠和硫酸溶液,用NaAlO2溶液制取Al(OH)3最好是通入过量二氧化碳制备,偏铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,反应方程式为NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3,故答案为:C;
(4)取54g铝土矿进行实验,最后得到氧化铝51g,实验过程没有损失,由铝元素守恒可知,则该铝土矿中铝的含量为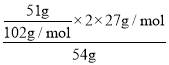 ×100%=50%,故答案为:50%。
×100%=50%,故答案为:50%。

 计算高手系列答案
计算高手系列答案