题目内容
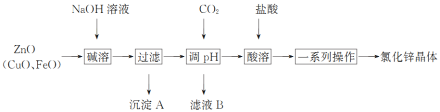
【题目】(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图示,然后回答问题:
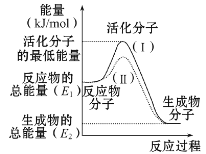
①图中所示反应是________(填“吸热”或“放热”)反应,该反应________ (填“需要”或“不需要”)加热,该反应的ΔH=________ (用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+ ![]() O2(g)====H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_____________。
O2(g)====H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_____________。
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A.CH3OH(g)+H2O(g)====CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
B.CH3OH(g)+ ![]() O2(g)====CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)====CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
另外H2O(l)====H2O(g) ΔH=+44 kJ/mol,请写出32 g 的CH3OH(g)完全燃烧生成液态水的热化学方程式______________________。
(3)已知反应2HI(g)![]() H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为__kJ。
H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为__kJ。
(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
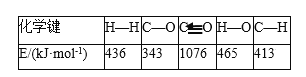
由此计算ΔH1=____kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=____kJ·mol-1。
【答案】放热 需要 —(E1-E2) 409kJ/mol CH3OH(g)+![]() O2(g)=CO2(g)+ 2H2O(l) ΔH=--280.9kJ/mol 299 -99 +41
O2(g)=CO2(g)+ 2H2O(l) ΔH=--280.9kJ/mol 299 -99 +41
【解析】
(1)①根据图,反应物总能量大于生成物总能量,即该反应为放热反应,化学反应中,只有极少数能量比平均能量高的的多的反应物分子发生碰撞才可能发生化学反应,所以反应需要能量;反应的焓变等于生成物的总能量与反应物总能量的差值,即△H=(E2-E1)kJ·mol-1或者为-(E1-E2)kJ·mol-1;
答案为放热 ;需要;(E2-E1)kJ·mol-1或者为-(E1-E2)kJ·mol-1;
②反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,根据图像能量关系可以知道,逆反应的活化能=正反应活化能+反应的焓变的绝对值,即该反应的逆反应活化能为(241.8kJ·mol-1+167.2kJ·mol-1)=409kJ·mol-1;
答案为409kJ·mol-1;
(2)甲醇燃烧生成液态水的方程式为CH3OH+![]() O2=CO2+2H2O(l),CH3OH(g)+
O2=CO2+2H2O(l),CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(g) △H=-192.9 kJ·mol-1…a,H2O(l)=H2O(g) △H=+44 kJ·mol-1…b,根据盖斯定律,推出a-2b得出CH3OH(g)+
O2(g)=CO2(g)+2H2O(g) △H=-192.9 kJ·mol-1…a,H2O(l)=H2O(g) △H=+44 kJ·mol-1…b,根据盖斯定律,推出a-2b得出CH3OH(g)+![]() O2(g) =CO2(g)+2H2O(l) △H=(-192.9-2×44)kJ·mol-1=280.9kJ·mol-1;
O2(g) =CO2(g)+2H2O(l) △H=(-192.9-2×44)kJ·mol-1=280.9kJ·mol-1;
答案为CH3OH(g)+![]() O2(g) =CO2(g)+2H2O(l) △H=280.9kJ·mol-1;
O2(g) =CO2(g)+2H2O(l) △H=280.9kJ·mol-1;
(3)令断裂1molHI分子中化学键吸收的能量为a,根据△H=反应物键能总和-生成物键能总和=2×akJ·mol-1-(436kJ·mol-1+151kJ·mol-1)=11kJ·mol-1,解得a=299;
答案为299;
(4)根据△H=反应物键能总和-生成物键能总和=1076kJ·mol-1+2×436kJ·mol-1-(343kJ·mol-1+3×413kJ·mol-1+465kJ·mol-1)=-99kJ·mol-1;根据盖斯定律,③=②-①,△H3=△H2-△H1=-58kJ·mol-1-(-99kJ·mol-1)=+41kJ·mol-1;
答案为-99;+41。

 阅读快车系列答案
阅读快车系列答案