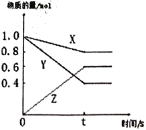
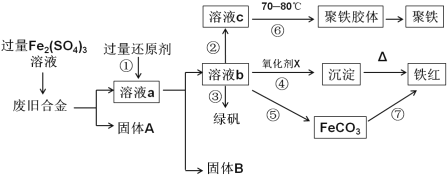
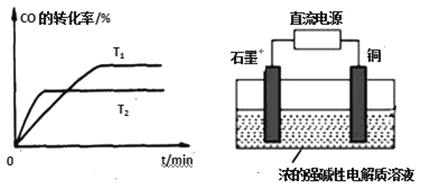
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃时,pH=1的盐酸溶液中,由水电离出的H+个数为10-13NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
C. 1L0.1molL-1NaHCO3溶液中含有0.1NA个HCO3-
D. 100gCaCO3与KHCO3的混合物中含有的阴离子的数目为NA
【答案】D
【解析】
A、水的电离方程式为:H2O![]() H++OH-,25℃时kw=c(H+)×c(OH-)═1×10-14,pH=1的盐酸,c(H+)=0.1mol/L,由水电离生成的c(H+)=c(OH-)=
H++OH-,25℃时kw=c(H+)×c(OH-)═1×10-14,pH=1的盐酸,c(H+)=0.1mol/L,由水电离生成的c(H+)=c(OH-)=![]() mol/L=10-13mol/L,但由于溶液体积未知,故不能计算由水电离出的H+个数,故A错误;
mol/L=10-13mol/L,但由于溶液体积未知,故不能计算由水电离出的H+个数,故A错误;
B、根据化学方程式中元素化合价变化和氧化还原反应规律同元素不同价态发生氧化还原反应,元素化合价只能靠近不能交叉,在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA,故B错误;
C、1L0.1mol/L的NaHCO3溶液中含有0.1mol溶质碳酸氢钠,由于碳酸氢根离子部分水解,则HCO3-离子数小于0.1NA,故C错误;
D、100 g CaCO3与KHCO3的混合物的物质的量为1mol,含有1mol阴离子,含有的阴离子的数目为NA,故D正确。
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:

注:已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Cu2+ |
开始沉淀PH | 2.5 | 7.0 | 4.7 |
完全沉淀PH | 3.7 | 9.0 | 6.7 |
下列说法不正确的是
A. 气体B为氢气
B. 溶液A中所含的阳离子可能是H+ 、 Fe3+ 、 Fe2+、 Cu2+
C. 加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 若沉淀E经洗涤、烘干、灼烧后得到固体mg,则试样中Cu的质量分数=(a-0.56)/a×100%