题目内容
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。
已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。将烟气通入 (NH4)2SO3溶液可以继续吸收SO2 ,用离子方程式表示出能吸收二氧化硫的原因_________。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
A.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_______________________________________。
②一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图1所示:
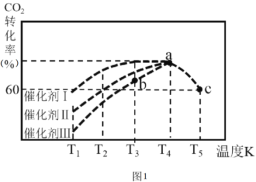
催化剂效果最佳的是催化剂 ______ (填“I”,“Ⅱ”,“Ⅲ”)。b点v(正)___v(逆) (填“>” ,“< ”,“=”)。此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_______。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=________。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
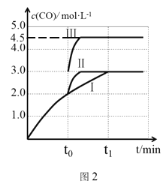
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
【答案】> SO32-+ SO2+ H2O= 2HSO3- BD CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= - 49kJ/mol 催化剂I > 该反应为放热反应,温度升高,平衡逆向移动 8.3×10-4或1/1200kPa-2 加入催化剂 将容器快速压缩至2L
CH3OH(g)+H2O(g) △H= - 49kJ/mol 催化剂I > 该反应为放热反应,温度升高,平衡逆向移动 8.3×10-4或1/1200kPa-2 加入催化剂 将容器快速压缩至2L
【解析】
(1)(NH4)2SO3溶液中存在NH4+和SO32-的水解,结合NH3·H2O和H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7分析水解能力的大小,判断溶液的酸碱性; (NH4)2SO3溶液吸收SO2 生成NH4HSO3,据此写出发生反应的离子方程式;(2)恒容条件下,反应达到平衡的标志依据“变量不变”方法判断,正逆反应速率相同,各组分含量保持不变;
(3)①根据图1可知0.5molCO2和1.5molH2转化率达80%时放热23-3.4=19.6KJ,然后按比例计算:CO2(g)+3H2(g)CH3OH(g)+H2O(g)的△H得出该反应的热化学方程式;②由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,故催化剂效果最佳的反应是反应Ⅰ;T3的b点时,反应未达到限度,故v(正)>v(逆);该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低。故T4的a点转化率比T5的c点高;
c点时时,CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始(mol):1 30 0
转化(mol):0.6 1.8 0.6 0.6
平衡(mol):0.41.2 0.60.6
代入平衡常数表达式计算;
(4)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变。
(1)已知NH3·H2O的电能平衡常数大于H2SO3的Ka2,则在(NH4)2SO3溶液中NH4+的水解能力小于SO32-的水解程度,可知溶液显碱性,即pH>7; (NH4)2SO3溶液吸收SO2 生成NH4HSO3,发生反应的离子方程式为SO32-+ SO2+ H2O= 2HSO3-;(2)在恒容条件下,能判断该反应一定达到化学平衡状态的依据是正逆反应速率相同,个组分含量不变,C(s)+2NO(g)N2(g)+CO2(g);A.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g),说明反应逆向进行,不能说明反应达到平衡状态,故A不符合;B.碳是固体.当平衡发生移动,气体质量会发生变化,容器体积不变,所以混合气体的密度不再发生改变可以说明反应达到平衡状态,故B符合;C.反应前后气体总物质的量不变,反应体系的压强始终不发生改变,不能判定平衡,故C不选;D.C为固体,混合气体的平均相对分子质量保持不变,可知气体的质量不变,为平衡状态,故D选;故答案为BD;(3)①已知0.5molCO2和1.5molH2转化率达80%时放热23-3.4=19.6KJ,则该反应的热化学方程式:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-![]() ×2=-49kJmol-1;②由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,催化剂效果最佳的反应是反应Ⅰ,T3的b点时,反应未到限度,故v(正)>v(逆);该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低。T4的a点转化率比T5的c点高,c点时:
×2=-49kJmol-1;②由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,催化剂效果最佳的反应是反应Ⅰ,T3的b点时,反应未到限度,故v(正)>v(逆);该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低。T4的a点转化率比T5的c点高,c点时:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始(mol):1 30 0
转化(mol):0.6 1.8 0.6 0.6
平衡(mol):0.41.2 0.60.6
在恒容恒温条件下,气体的压强与气体的物质的量成正比,则平衡时总压强P总=100kPa×![]() =70 kPa,该反应的平衡常数Kp=
=70 kPa,该反应的平衡常数Kp=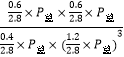 =8.3×10-4 kPa-2;(4)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L满足条件。
=8.3×10-4 kPa-2;(4)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L满足条件。

 名校课堂系列答案
名校课堂系列答案

