题目内容
【题目】将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为____________,H2(g)的平衡转化率为___________,在此温度下,该反应的平衡常数K=____________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是_________(填入下列条件的序号,下同),乙条件可能是__________。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是___________(用含一个a、b、c的代数式表示)
【答案】0.05mol/L 45% 29.5 ③⑤ ④ 2(a+c/2)=(b+c/2) 或 4a-2b+c=0
【解析】
(1)平衡时HI体积分数为0.6,反应前后气体总物质的量不变,则平衡时HI为(1mol+2mol)×0.6=1.8mol,根据方程式可知,消耗I2(g)的物质的量为1.8mol×![]() =0.9mol,故平衡时I2(g)的浓度为
=0.9mol,故平衡时I2(g)的浓度为![]() =0.05mol/L,消耗H2(g)的物质的量为1.8mol×
=0.05mol/L,消耗H2(g)的物质的量为1.8mol×![]() =0.9mol,H2(g)的平衡转化率为
=0.9mol,H2(g)的平衡转化率为![]() ×100%=45%;平衡时c(I2)= 0.05mol/L,c(H2)=
×100%=45%;平衡时c(I2)= 0.05mol/L,c(H2)= ![]() =0.55mol/L,c(HI)=
=0.55mol/L,c(HI)= ![]() = 0.9mol/L,此温度下,该反应的平衡常数K=
= 0.9mol/L,此温度下,该反应的平衡常数K=![]() =29.5,故答案为:0.05mol/L;45%;29.5;
=29.5,故答案为:0.05mol/L;45%;29.5;
(2)曲线(Ⅰ)与曲线(Ⅱ)相比,到达平衡时间缩短,反应速率加快,平衡时HI体积发生不变,平衡不移动,可能使用催化剂,由于反应前后气体体积不变,也可能是增大压强,故选:③⑤;曲线(Ⅲ)与曲线(Ⅱ)相比,到达平衡时更长,反应速率减慢,平衡时HI体积分数不变,平衡不移动,由于反应前后气体体积不变,应是减小压强,故选④,故答案为:③⑤;④;
(3)改变物质起始投入量,平衡时HI的体积分数不变,与原平衡为等效平衡,恒温恒容下,反应前后气体体积不变,按化学计量数转化到方程式左边满足与原平衡投料比相同,即满足n(I2):n(H2)=1:2即可,即(a+![]() c):(b+
c):(b+![]() c)=1:2,整理可得:4a+c=2b,故答案为:4a+c=2b。
c)=1:2,整理可得:4a+c=2b,故答案为:4a+c=2b。

 阅读快车系列答案
阅读快车系列答案【题目】从报废后的锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等)中回收有关物质,回收工艺流程如下:
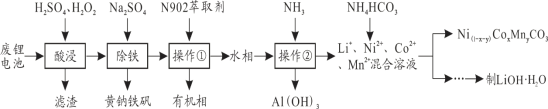
(1)操作②的名称为_______________,操作①的目的是___________________________。
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式_______________________。
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
物质 | Al(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
Ksp | 1×10-35 | 2×10-13 | 6×10-15 | 4×10-15 |
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为_________。(保留1位小数)
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为_______。该材料可通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到,反应中不能隔绝空气,其原因是_______________________________________________________。