题目内容
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加![]() 溶液制备
溶液制备![]() 胶体:
胶体:![]()
B.用![]() 溶液腐蚀印刷铜电路板:
溶液腐蚀印刷铜电路板:![]()
C.用小苏打治疗胃酸过多:![]()
D.实验室用浓盐酸与![]() 反应制
反应制![]() :
:![]()
【答案】C
【解析】
A. 向沸水中滴加FeCl3溶液制备胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故A错误;
Fe(OH)3(胶体)+3H+,故A错误;
B. 用![]() 溶液腐蚀印刷铜电路板,反应实质为铁离子与铜反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故B错误;
溶液腐蚀印刷铜电路板,反应实质为铁离子与铜反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故B错误;
C. 小苏打为碳酸氢钠,胃酸为盐酸,所以小苏打治疗胃酸过多离子方程式为![]() ,故C正确;
,故C正确;
D. 实验室制取氯气的离子方程式为MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O,故D错误;
Cl2↑+Mn2++2H2O,故D错误;
故答案为C。

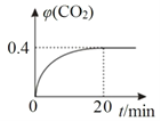
【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)写出该反应的压强平衡常数的表达式Kp______。
(2)判断该反应达到平衡状态的依据有_________。
A.消耗CH3OH的速率与消耗CO的速率相等 B.混合气体的平均相对分子质量不变
C.混合气体的密度不变 D.容器内气压不变
(3)根据上表数据,要同时提高CO的平衡转化率和反应速率,可采取的措施是______。
A.升温 B.充入H2 C.分离出甲醇 D.加入催化剂
(4)250℃时,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol·L-1,则以H2表示的反应速率v(H2)=_____。平衡后再向容器中加入0.1 mol CO和 0.4 mol CH3OH,则此时v正___v逆(填“>”、“<”或“=”)。
(5)CO还可以用做燃料电池的燃料。若电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,电池在650 ℃下工作时,其正极反应式:O2+ 2CO2 + 4e-=2CO32-,则负极反应式为:________。
【题目】反应 Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常数为 K1,反应 Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常数为 K2;在不同温度时 K1、K2 的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
(1) 反应 CO2(g)+H2(g)CO(g)+H2O(g)的反应热为△H ,平衡常数为 K,则△H= ____________(用△H1 和△H2 表 示), K= _______________ (用 K1 和 K2 表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是______________________________反应(填“吸热”或“放热”)。
(2) 现有反应:mA(g)+nB(g) pC(g)达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为反应___________(填“吸热”或“放热”,且 m+n___p(填“>"“=或“<”)
②减压使容器容积增大时,A的质量分数____________(填“增大”“减小”或“不变”,下同)。
③若容积不变加入B,则A的转化率_______________, B的转化率 ______________
④ 若加入催化剂,平衡时气体混合物的总物质的量____________