题目内容
【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)写出该反应的压强平衡常数的表达式Kp______。
(2)判断该反应达到平衡状态的依据有_________。
A.消耗CH3OH的速率与消耗CO的速率相等 B.混合气体的平均相对分子质量不变
C.混合气体的密度不变 D.容器内气压不变
(3)根据上表数据,要同时提高CO的平衡转化率和反应速率,可采取的措施是______。
A.升温 B.充入H2 C.分离出甲醇 D.加入催化剂
(4)250℃时,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol·L-1,则以H2表示的反应速率v(H2)=_____。平衡后再向容器中加入0.1 mol CO和 0.4 mol CH3OH,则此时v正___v逆(填“>”、“<”或“=”)。
(5)CO还可以用做燃料电池的燃料。若电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,电池在650 ℃下工作时,其正极反应式:O2+ 2CO2 + 4e-=2CO32-,则负极反应式为:________。
【答案】Kp=![]() ABD B 0.16 mol/(L·min) = 2CO + 2CO32--4e-=4CO2
ABD B 0.16 mol/(L·min) = 2CO + 2CO32--4e-=4CO2
【解析】
(1)平衡常数K等于生成物浓度幂之积除以反应物幂之积,据此书写平衡常数表达式
(2)达到平衡状态时,正反应速率等于逆反应速率,且各物质的浓度不随时间的变化而变化,据此判断平衡状态;
(3)由表格可知升高温度,平衡常数减小,正反应为放热,再结合勒夏特列原理进行分析;
(4)根据v=![]() 计算速率,根据平衡的移动判断正逆反应速率的大小关系;
计算速率,根据平衡的移动判断正逆反应速率的大小关系;
(5)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,得失电子相等时,正负电极反应的和即为电池的总反应。
(1)由平衡常数的定义得压强平衡常数表达式为:Kp=![]() ;
;
(2)A.消耗CH3OH为逆反应,消耗CO为正反应,速率相等,即有v(正)=v(逆),反应达到平衡该状态,A项正确;
B.该反应为非等体积反应,混合气体的平均相对分子质量不变,证明反应达到平衡状态,B项正确;
C.反应的总质量不变,在恒容密闭容器中,气体体积不变,则混合气体的密度不变,不能证明达到平衡状态,C项错误;
D.该反应为非等体积反应,容器内气压不变,反应达到平衡状态,D项正确;
答案选ABD;
(3)A.由表格可知升高温度,平衡常数减小,正反应为放热,升高温度,平衡向着吸热的方向移动,即平衡逆向移动,CO的平衡转化率减小,反应速率加快,A项错误;
B. 充入H2,平衡正向移动,CO的平衡转化率增大,反应速率加快,B项正确;
C. 分离出甲醇,平衡正向移动,CO的平衡转化率增大,反应速率减小,C项错误;
D. 加入催化剂,反应速率加快,平衡不移动,CO的平衡转化率不变,D项错误;
答案选B;
(4)设起始时H2的浓度为x mol/L
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
始(mol/L) 1 x 0
转(mol/L) 0.8 1.6 0.8
平(mol/L) 0.2 x-1.6 0.8
v=![]() =
=![]() =0.16 mol/(L·min);
=0.16 mol/(L·min);
250℃时K=2.0,可知K=![]() =2.0,那么x=3.0mol/L
=2.0,那么x=3.0mol/L
平衡后再向容器中加入0.1 mol CO和 0.4 mol CH3OH,此时QC=K=2.0,反应达到平衡状态,即有v正=v逆;
(5)燃料电池中,总反应为CO+O2=2CO2,正极反应为O2+ 2CO2 + 4e-=2CO32-,相减可得负极反应为:2CO + 2CO32--4e-=4CO2。

【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
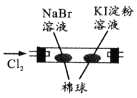
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D