题目内容
【题目】下列叙述正确的是
A.某温度时 N2(g)+3H2(g)![]() 2NH3(g),正、逆反应的平衡常数分别为 K1、K2,则 K1·K2=1
2NH3(g),正、逆反应的平衡常数分别为 K1、K2,则 K1·K2=1
B.若一个可逆反应的化学平衡常数很大,则该反应会在较短的时间内完成
C.氢氧燃料电池是一种将热能转化为电能的装置
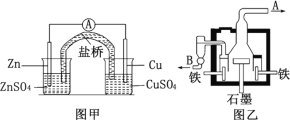
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
【答案】A
【解析】
A.N2(g)+3H2(g)![]() 2NH3(g),正、逆反应的平衡常数分别为 K1=
2NH3(g),正、逆反应的平衡常数分别为 K1=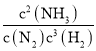 、K2=
、K2=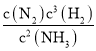 ,K1·K2=1,故A正确;
,K1·K2=1,故A正确;
B.若一个可逆反应的化学平衡常数很大,说明反应进行的程度很大,不能说明反应速率很快,故B错误;
C.燃料电池属于原电池,原电池是将化学能转化为装化为电能的装置,故C错误;
D.电解池中,连接电源负极的阴极受保护,将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀,故D错误;
答案选A。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有_________________________________________。
A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是______________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是___________________。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?____________(填“能”或“不能”),理由是_________________________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取_______g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有_____________。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将__________(填“偏大”、“偏小”或“不变”)。