题目内容
【题目】研究发现,NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=___________。
2CO2(g)+N2(g) △H=___________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=___________;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将___________ (填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是___________(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为___________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为___________g。

【答案】-744 kJ·mol-1 0.875 不 AC NO+6H++5e=NH4++H2O 32
【解析】
(1) ① N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1
根据盖斯定律,②-①得2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-564 kJ·mol-1-180 kJ·mol-1=-744 kJ·mol-1;
2CO2(g)+N2(g) △H=-564 kJ·mol-1-180 kJ·mol-1=-744 kJ·mol-1;
(2) T℃时达到平衡,根据图像可知

①Kp= ;T℃时
;T℃时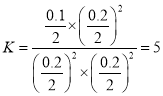 ,平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,Qc=
,平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,Qc=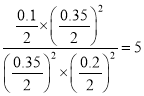 =K,所以平衡不移动;
=K,所以平衡不移动;
②根据图像,15min时NO的物质的量逐渐减小;
A.增大CO浓度,平衡正向移动,NO的物质的量逐渐减小,故选A;
B.正反应放热,升温平衡逆向移动,NO的物质的量逐渐增大, 故不选B;
C.减小容器体积,压强增大,平衡正向移动, NO的物质的量逐渐减小,故选C;
D.加入催化剂,平衡不移动,NO的物质的量不变,故不选D;
选AC;
(3)根据题意,NO在阴极得电子生成NH4+,通入NO的电极反应式为NO+6H++5e=NH4++H2O;根据得失电子数目守恒,有2NO10e5SO2,则SO2的物质的量为:n(SO2)=![]() n(NO)=
n(NO)=![]() ×
×![]() =0.5mol,SO2的质量为64g/mol×0.5mol=32g。
=0.5mol,SO2的质量为64g/mol×0.5mol=32g。

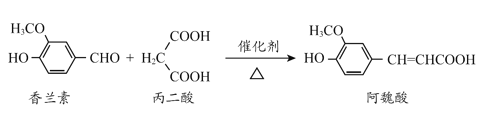
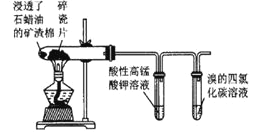
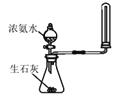
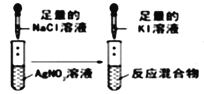
【题目】下列实验装置中所用仪器、试剂、现象和结论均正确的是
选项 | 装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀生成 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有乙烯 |
C |
| 分液漏斗液体流下,锥形瓶中产生大量气体 | 快速制备和收集一定量的氨气 |
D |
| 试管中依次出现白色,黄色沉淀 | 说明 Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
【题目】一定温度下,在三个容积均为 1.0L 的恒容密闭容器中发生反应: CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 乙酸的平衡浓度/ mol/L | 平衡常数 | ||
c(CH3OH) | c(CH3OH) | c(CH3COOH) | c(CH3COOH) | |||
I | 530 | 0.50 | 0.5 | 0 | 0..40 | K1 |
II | 530 | 0.20 | 0.2 | 0.4 | K2 | |
III | 510 | 0 | 0 | 0.5 | K3 | |
A.三个容器中的平衡常数 K1<K2< K3
B.达平衡时,容器I与容器II中的总压强之比为3 : 4
C.达平衡时,容器I中CH3OH转化率与容器 III 中CH3COOH转化率之和小于l
D.达平衡时,容器III中的正反应速率比容器I中的大