题目内容
【题目】电解法利用 CO2制备甲酸盐可实现 CO2资源化利用, 其装置如图所示:

下列说法错误的是
A.a 极为正极,K+由左向右通过交换膜
B.乙池中的反应为 CO2+HCO3-+2e-= HCOO-+ CO32-
C.电解过程中,Pt 电极产生的气体可以用作燃料电池的负极反应
D.两池的溶液 KHCO3浓度均降低
【答案】C
【解析】
根据电解CO2制甲酸盐的装置可知,Sn电极为阴极,阴极CO2发生还原反应生成HCOO-,电极反应为:CO2+HCO3-+2e-═HCOO-+CO32-,阳极为Pt电极,电解一段时间后,阳极氢氧根离子失电子生成氧气,促进水的电离,电极附近氢离子浓度增大,HCO3-浓度降低,电极反应式为4HCO3--4e-=O2↑+4CO2↑+2H2O。
A.根据以上分析,Sn电极为阴极,阴极CO2发生还原反应生成HCOO-,所以b是电源负极,a 极为正极,K+由左向右通过交换膜,故A正确;
B.乙池Sn电极为阴极,阴极CO2发生还原反应生成HCOO-,电极反应为:CO2+HCO3-+2e-═HCOO-+CO32-,故B正确;
C.阳极为Pt电极,电解一段时间后,阳极氢氧根离子失电子生成氧气,电极反应式为4HCO3--4e-=O2↑+4CO2↑+2H2O,电解过程中,Pt 电极产生的气体O2和CO2可作氧化剂,不能用作燃料电池的负极反应,故C错误;
D.甲池为阳极,电极反应式为4HCO3--4e-=O2↑+4CO2↑+2H2O,乙池为阴极,电极反应为:CO2+HCO3-+2e-═HCOO-+CO32-,则两池中KHCO3溶液浓度均降低,故D正确;
故选C。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应,也不与氢氧化钠反应),实验步骤如下:
①配制![]() 稀盐酸和
稀盐酸和![]() 溶液各
溶液各![]()
②取一粒药片(![]() )研碎后加入
)研碎后加入![]() 蒸馏水
蒸馏水
③加入![]() 稀盐酸
稀盐酸
④用![]() 溶液中和过量盐酸,用去体积为
溶液中和过量盐酸,用去体积为![]() 。
。
请回答下列问题:
(1)测定过程中发生反应的离子方程式_________。
(2)配制上述![]() 稀盐酸所用玻璃仪器有量筒、烧杯、________。
稀盐酸所用玻璃仪器有量筒、烧杯、________。
(3)如果选用酚酞作指示剂,滴定达到终点的现象为____。
(4)某同学四次测定的![]() 数据如下:
数据如下:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 13.40 | 11.90 | 12.10 | 12.00 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数为_____。
(5)若在实验过程中存在下列操作,会使所测碳酸钙的质量分数偏高的是_________。
a 用没有润洗的碱式滴定管装![]() 溶液进行滴定
溶液进行滴定
b 用没有润洗的酸式滴定管量取![]() 稀盐酸溶解样品
稀盐酸溶解样品
c 用![]() 溶液滴定时,开始读数平视,终点俯视
溶液滴定时,开始读数平视,终点俯视
d 装![]() 溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
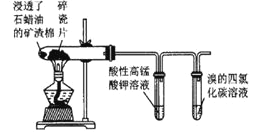
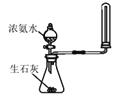
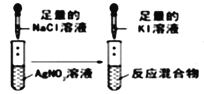
【题目】下列实验装置中所用仪器、试剂、现象和结论均正确的是
选项 | 装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀生成 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有乙烯 |
C |
| 分液漏斗液体流下,锥形瓶中产生大量气体 | 快速制备和收集一定量的氨气 |
D |
| 试管中依次出现白色,黄色沉淀 | 说明 Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
【题目】常温下,将某一元酸 HA 和 NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH 如表:
实验编号 | HA物质的量浓度/(molL-1) | NaOH物质的量浓度/( molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.2 | pH=a |
请回答:
(1)用离子方程式表示①组混合溶液显碱性的原因是_____。
(2)②组中c_____0.2(填“>”、“<”或“=”,下同);③组中 a_____9。
(3)常温下,HA 的电离平衡常数的值为_____。
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为_____。