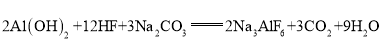题目内容
【题目】A、B、C、D、E、F、G是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
编号 | 基本信息 | 解决的问题 |
① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 | 这两种元素分别是______(填元素符号,下同)、______. |
② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素的单质、氧化物及氧化物对应的水化物均能与NaOH溶液反应 | 这两种元素分別是______、______. |
③ | G能与A、E分别形成原子个数比均为 | X的分子式为______, |
(1)仅由表中信息还不能确定的元素是______(填字母序号),若要确定其是何种元素,还需要的条件是______(填序号).
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
e.单质在常温下为固体
d.简单氯化物的稳定性比![]() 的简单氯化物强
的简单氯化物强
(2)基本信息②中,两种元素的氧化物分别与NaOH溶液反应的离子方程式为__________________,__________________.
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
【答案】O Na Al Si CCl4 第三周期![]() 族 F b
族 F b 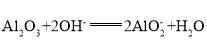
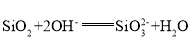
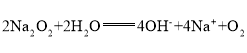
【解析】
短周期元素中电子层数与最外层电子数之比为![]() 的元素是氧,为
的元素是氧,为![]() 的元素是钠,短周期元素中氧化物与强酸、强碱均能反应的是
的元素是钠,短周期元素中氧化物与强酸、强碱均能反应的是![]() ,单质、氧化物及对应水化物均能与
,单质、氧化物及对应水化物均能与![]() 溶液反应的元素是
溶液反应的元素是![]() ,由③中化合物的原子个数比及原子序数关系可知,A是碳,E是硅,G是氯,进一步可推知D是铝,C是钠,B是氧,F是磷或硫,硫、磷单质在常温下均为固体,均能与氧气反应且简单氢化物的稳定性均比
,由③中化合物的原子个数比及原子序数关系可知,A是碳,E是硅,G是氯,进一步可推知D是铝,C是钠,B是氧,F是磷或硫,硫、磷单质在常温下均为固体,均能与氧气反应且简单氢化物的稳定性均比![]() 强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;钠与氧能形成符合条件的两种常见化合物
强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;钠与氧能形成符合条件的两种常见化合物![]() 、
、![]() ,据此回答。
,据此回答。
据上分析可知,A是碳,E是硅,G是氯,D是铝,C是钠,B是氧,;G能与A、E分别形成原子个数比均为![]() 的分子为CCl4、SiCl4;而Si核电荷数为14,有三个电子层,最外层电子数为4,因此其位于第三周期
的分子为CCl4、SiCl4;而Si核电荷数为14,有三个电子层,最外层电子数为4,因此其位于第三周期![]() 族;
族;
答案为:①O;Na ②Al;Si ③CCl4;第三周期![]() 族;
族;
(1)E、F、G原子序数依次增大,而E是硅,G是氯,所以F只能是磷或硫,仅由表中信息还不能确定的元素是F;硫、磷单质在常温下均为固体,均能与氧气反应且简单氢化物的稳定性均比![]() 强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;因此若要确定还需要的条件是b;
强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;因此若要确定还需要的条件是b;
答案为:F;b;
(2)基本信息②中,两种元素的氧化物分别氧化铝、二氧化硅,分别与NaOH溶液反应,离子方程式: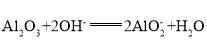 ,
,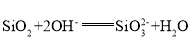 ;
;
答案为: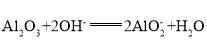 ,
, 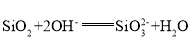 ;
;
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物为
的两种能与水反应的常见化合物为![]() 、
、![]() ;
;![]() 与H2O反应的离子方程式:
与H2O反应的离子方程式: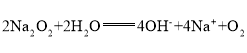 ;
;
答案为: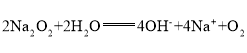 。
。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案