题目内容
【题目】化学与生产、生活及环境密切相关,下列有关说法不正确的是( )
A.餐具上的油污可用热的纯碱溶液清洗,纺织品上的油污不可以用烧碱溶液清洗
B.工业生产时加入适宜的催化剂,除了可以加快反应速率之外,还可以降低反应所需的温度,从而减少能耗
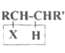
C.一定条件下,1mol 化合物X(![]() )最多可以与2molNaOH反应
)最多可以与2molNaOH反应
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
【答案】C
【解析】
A. 餐具上的油污可用热的纯碱溶液清洗,烧碱碱性太强,容易破坏纺织品,纺织品上的油污不可以用烧碱溶液清洗,故A正确;
B. 催化剂通过降低活化能加快反应速率,工业生产时加入适宜的催化剂,除了可以加快反应速率之外,还可以降低反应所需的温度,从而减少能耗,故B正确;
C. ![]() 含有的官能团是酯基、氯原子,一定条件下,1mol 化合物
含有的官能团是酯基、氯原子,一定条件下,1mol 化合物![]() 最多可以与3molNaOH反应,故C错误;
最多可以与3molNaOH反应,故C错误;
D. 高锰酸钾可以氧化乙烯,用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的,故D正确;
选C。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
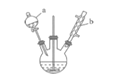
已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
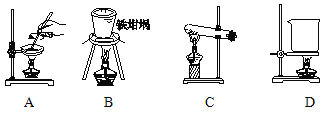
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。
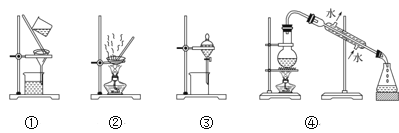
(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
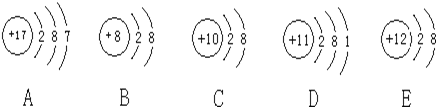
【题目】A、B、C、D、E、F、G是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
编号 | 基本信息 | 解决的问题 |
① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 | 这两种元素分别是______(填元素符号,下同)、______. |
② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素的单质、氧化物及氧化物对应的水化物均能与NaOH溶液反应 | 这两种元素分別是______、______. |
③ | G能与A、E分别形成原子个数比均为 | X的分子式为______, |
(1)仅由表中信息还不能确定的元素是______(填字母序号),若要确定其是何种元素,还需要的条件是______(填序号).
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
e.单质在常温下为固体
d.简单氯化物的稳定性比![]() 的简单氯化物强
的简单氯化物强
(2)基本信息②中,两种元素的氧化物分别与NaOH溶液反应的离子方程式为__________________,__________________.
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.