��Ŀ����
����Ŀ���о���ѧ��Ӧʱ����Ҫ�������ʱ仯�������仯��ҲҪ��ע��Ӧ�Ŀ������ȡ��ش���������:
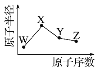
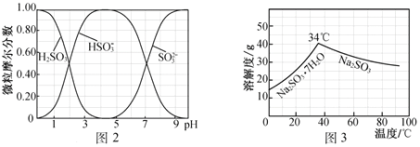
(1)ij�¶�ʱ����2 L������A��B�������ʼ��ת����Ӧ�У�A��B���ʵ�����ʱ��仯����������ͼ��ʾ����ͼ�����ݷ����ã�(A��B��Ϊ����)
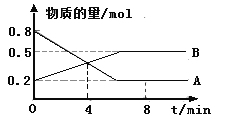
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ____________________��
�ڷ�Ӧ��ʼ��4 minʱ��B��ƽ����Ӧ����Ϊ________ ��
��4 minʱ����Ӧ�Ƿ�ﵽƽ��״̬��________(����������������)��8 minʱ��v(��)________v(��)(������������������������)��
(2)�̶�������CO2����Ч��������Դ�������ٿ����е��������塣��ҵ����һ����CO2�������״�ȼ�ϵķ�����CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)��ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ���ߢ���ʾ��a��b��c��d��e���������ݱ�ʾ���꣮
CH3OH(g)+H2O(g)��ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ���ߢ���ʾ��a��b��c��d��e���������ݱ�ʾ���꣮
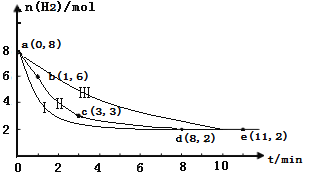
��a��b��b��c��c��d��d��e�Ķ��У�ƽ����Ӧ��������ʱ�����___________ ����ʱ�����CO2��ƽ����Ӧ������________��
�����ڷ�Ӧ�м����˴�������Ӧ���̽���Ϊͼ�е�����_____ (������������������������)��
��ƽ��ʱCO2��ת������_________����Ӧǰ�������ڵ�ѹǿ����__________��
���𰸡�2A(g)![]() B(g) 0.025mol/(Lmin) �� �� a��b 1/3mol/(L min) �� 33% 7:5
B(g) 0.025mol/(Lmin) �� �� a��b 1/3mol/(L min) �� 33% 7:5
��������
����ͼ�����ݼ���Ӧ����ʽ���㷴Ӧ���ʣ�����ͼ�����ݷ����Ƿ�ﵽƽ��״̬������ת���ʵ���ؼ��㡣
(1)����ͼ��֪��ͬʱ���ڣ�A���ʵ�������0.6mol��B���ʵ�������0.3mol�����Ը÷�Ӧ�Ļ�ѧ����ʽΪ2A(g)![]() B(g)��
B(g)��
�ڸ���ͼ�еı�����ϵ��֪����Ӧ��ʼ��4 minʱ��n(B)=0.4mol����v(B)=![]() ��
��
����ͼʾ֪4 minʱ����Ӧ������������ʵ������ڱ仯�����Է�Ӧû�дﵽƽ��״̬��8 minʱ����Ӧ������������ʵ������ٱ仯����Ӧ�ﵽƽ��״̬������v(��)=v(��)��
(2)����ͼ��ʾ���տ�ʼʱ����Ӧ���Ũ�ȴ�����ƽ����Ӧ��������ʱ�����a��b��v(H2)=![]() ����v(CO2)=1/3v(H2)=1/3��1mol/(L min)=1/3mol/(L min)��
����v(CO2)=1/3v(H2)=1/3��1mol/(L min)=1/3mol/(L min)��
�ڷ�Ӧ�м����˴�������Ӧ���ʼӿ죬����ƽ�����õ�ʱ����٣���ƽ��״̬��ͬ����Ӧ���̽���Ϊͼ�е���������
����ͼ��ʾƽ��ʱn(H2)=2mol����Ӧ���ĵ�����Ϊ 8mol-2mol=6mol�����ĵĶ�����̼Ϊ 6mol��1/3=2mol����ƽ��ʱCO2��ת������![]() =33%��ƽ��ʱ���ɵ� CH3OH��H2O���ʵ����ֱ�Ϊ��6mol��1/3=2mol����Ӧǰ�������ڵ�ѹǿ�ȵ��ڷ�Ӧǰ���������ʵ���֮�ȣ�
=33%��ƽ��ʱ���ɵ� CH3OH��H2O���ʵ����ֱ�Ϊ��6mol��1/3=2mol����Ӧǰ�������ڵ�ѹǿ�ȵ��ڷ�Ӧǰ���������ʵ���֮�ȣ�![]() 7:5���ʴ�Ϊ��a��b��1/3mol/(L min)������33%��7:5��
7:5���ʴ�Ϊ��a��b��1/3mol/(L min)������33%��7:5��