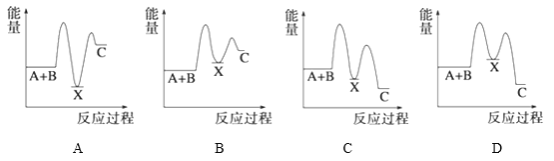
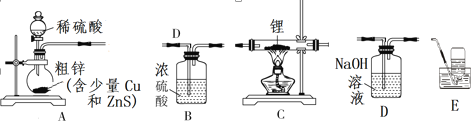
题目内容
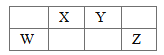
【题目】W、X、Y、Z是四种短周期主族元素,其原子半径随原子序数的变化如图。已知W是地壳中含量最高的元素;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
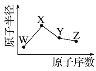
A. 对应的简单离子的半径:X<W
B. 对应的简单气态氢化物的稳定性:Y>Z
C. 元素X、Z分别与W能形成多种化合物
D. Z的最高价氧化物对应的水化物具有强酸性
【答案】B
【解析】
W、X、Y、Z是四种常见的短周期元素,已知W是地壳中含量最高的元素,故W为O元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于O原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,结合元素周期律分析解答。
根据上述分析,W为O元素,X为Na元素,Y为Si元素,Z为Cl元素。
A.W为O元素,X为Na元素,电子层结构相同的离子,核电荷数越大,离子半径越小,故离子半径O2->Na+,故A正确;
B.Y为Si元素,Z为Cl元素,非金属性Cl>Si,故氢化物稳定性Y(Si)<Z(Cl),故B错误;
C.X为Na元素,Z为Cl元素,W为O元素,能够形成的化合物分别有氧化钠、过氧化钠,二氧化氯,七氧化二氯等,故C正确;
D.氯的最高价氧化物对应的水化物为高氯酸,是强酸,故D正确;
答案选B。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目