题目内容
【题目】N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
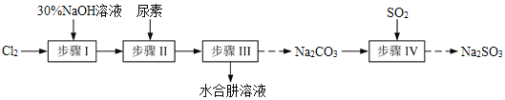
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
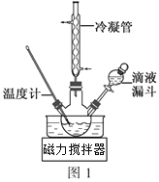
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
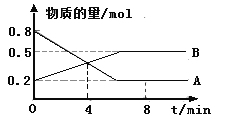
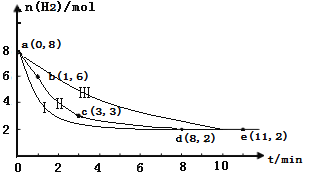
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
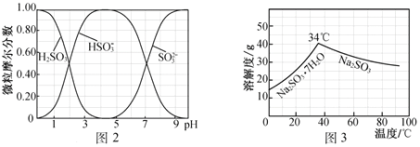
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_________________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
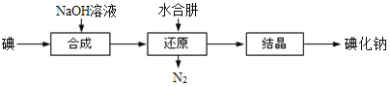
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
【答案】BC缓慢通入Cl2b过量的NaClO溶液会将水合肼氧化减压蒸馏测量溶液的pH,若pH约为4,停止通SO2边搅拌边滴加NaOH溶液,并监测溶液pH,当pH接近10时,停止加液,将溶液转移到蒸发皿中,低温蒸发至较多晶体析出,趁热过滤(不得低于34℃)N2H4H2O的氧化产物为N2和H2O,分离产品过程容易进行
【解析】
由实验流程可知步骤Ⅰ为氯气和氢氧化钠溶液的反应,生成NaClO,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,结合对应物质的性质以及题给信息解答该题。
(1)配制30%NaOH溶液时,需要用托盘天平称取一定量的氢氧化钠固体,如何在烧杯中加入适量的水溶解即可,所需玻璃仪器除量筒、烧杯外,还需要玻璃棒和胶头滴管,故答案为:BC;
(2)温度超过40℃,Cl2与NaOH溶液反应生成 NaClO3和NaC1,反应的离子方程式为3Cl2+6OH- ![]() ClO3-+5Cl-+3H2O,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高,故答案为:缓慢通入氯气;
ClO3-+5Cl-+3H2O,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高,故答案为:缓慢通入氯气;
(3)实验中通过滴液漏斗滴加的溶液是NaClO碱性溶液,可以避免过量的NaClO溶液会将水合肼氧化生成N2,故答案为:b;过量的NaClO溶液会将水合肼氧化;
(4)根据题意,N2H4·H2O(水合肼)不稳定,100℃以上易分解失水,熔点为-40℃,沸点118.5℃。步骤Ⅲ中分离出N2H4·H2O应该采用减压蒸馏,故答案为:减压蒸馏;
(5)用Na2CO3制备无水Na2SO3,在Na2CO3溶液中通入过量的二氧化硫生成NaHSO3,然后在NaHSO3溶液中加入NaOH溶液可生成Na2SO3。
①由图像可知,如溶液pH约为4时,可完全反应生成NaHSO3,此时可停止通入二氧化硫,可通过测量溶液pH的方法控制,故答案为:测量溶液的pH,若pH约为4,停止通SO2;
②由 NaHSO3溶液制备无水Na2SO3,可边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,由图像可知pH约为10时,可完全反应生成Na2SO3,此时停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,由图像3可知在高于34℃条件下趁热过滤,可得到无水Na2SO3,故答案为:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤。
(6) N2H4H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质,水合肼还原法制得的产品纯度更高,故答案为:N2H4H2O的氧化产物为N2和H2O,分离产品过程容易进行。

【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
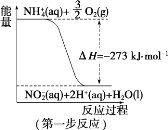

①第一步反应是_________________(填“放热”或“吸热”)反应,判断依据是___________。
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是_________________。
(2)已知红磷比白磷稳定,则反应 P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1;4P(红磷,s)+ 5O2(g)===2P2O5(s)ΔH2;ΔH1 和 ΔH2 的关系是 ΔH1____________ΔH2(填“>”、“<”或“=”)。
(3)在 298 K、101 kPa 时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1;Cl2(g)+H2(g)===2HCl(g) ΔH2;2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则 ΔH3 与 ΔH1 和 ΔH2 之间的关系正确的是___________。
A ΔH3=ΔH1+2 ΔH2 B ΔH3=ΔH1+ΔH2
C ΔH3=ΔH1-2ΔH2 D ΔH3=ΔH1-ΔH2
(4)已知 H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发 1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中 a=__________________。