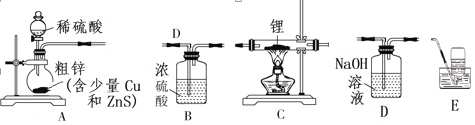
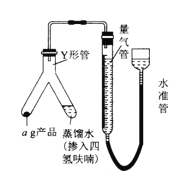
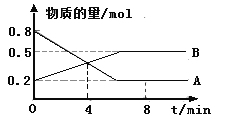
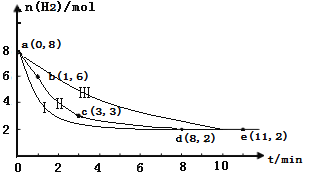
题目内容
【题目】化学学习中常用类推方法,下列类推正确的是![]()
![]()
A. ![]() 为直线形分子,
为直线形分子,![]() 也为直线形分子
也为直线形分子
B. 固态![]() 是分子晶体,固态
是分子晶体,固态![]() 也是分子晶体
也是分子晶体
C. ![]() 中N原子是
中N原子是![]() 杂化,
杂化,![]() 中B原子也是
中B原子也是![]() 杂化
杂化
D. ![]() 能溶于NaOH溶液,
能溶于NaOH溶液,![]() 也能溶于NaOH溶液
也能溶于NaOH溶液
【答案】D
【解析】A项,SO2为V形分子;B项,SiO2属于原子晶体;C项,BCl3中B原子为sp2杂化;D项,Al(OH)3和Be(OH)2都属于两性氢氧化物,都能溶于NaOH溶液。
A项,CO2中中心原子C上的孤电子对数为![]() (4-2
(4-2![]() 2)=0,σ键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线形,由于C上没有孤电子对,CO2为直线形分子,SO2中中心原子S上的孤电子对数为
2)=0,σ键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线形,由于C上没有孤电子对,CO2为直线形分子,SO2中中心原子S上的孤电子对数为![]() (6-2
(6-2![]() 2)=1,σ键电子对数为2,价层电子对数为1+2=3,VSEPR模型为平面三角形,由于S上有一对孤电子对,SO2为V形分子,A项错误;B项,固体CS2是分子晶体,固体SiO2属于原子晶体,B项错误;C项,NCl3中中心原子N上的孤电子对数为
2)=1,σ键电子对数为2,价层电子对数为1+2=3,VSEPR模型为平面三角形,由于S上有一对孤电子对,SO2为V形分子,A项错误;B项,固体CS2是分子晶体,固体SiO2属于原子晶体,B项错误;C项,NCl3中中心原子N上的孤电子对数为![]() (5-3
(5-3![]() 1)=1,σ键电子对数为3,价层电子对数为1+3=4,NCl3中N为sp3杂化,BCl3中中心原子B上的孤电子对数为
1)=1,σ键电子对数为3,价层电子对数为1+3=4,NCl3中N为sp3杂化,BCl3中中心原子B上的孤电子对数为![]() (3-3
(3-3![]() 1)=0,σ键电子对数为3,价层电子对数为0+3=3,BCl3中B为sp2杂化,C项错误;D项,Be和Al在元素周期表中处于对角线,根据“对角线规则”,Be(OH)2与Al(OH)3性质相似,两者都属于两性氢氧化物,都能溶于NaOH溶液,Al(OH)3、Be(OH)2与NaOH溶液反应的化学方程式分别为Al(OH)3+NaOH=NaAlO2+2H2O、Be(OH)2+2NaOH=Na2BeO2+2H2O,D项正确;答案选D。
1)=0,σ键电子对数为3,价层电子对数为0+3=3,BCl3中B为sp2杂化,C项错误;D项,Be和Al在元素周期表中处于对角线,根据“对角线规则”,Be(OH)2与Al(OH)3性质相似,两者都属于两性氢氧化物,都能溶于NaOH溶液,Al(OH)3、Be(OH)2与NaOH溶液反应的化学方程式分别为Al(OH)3+NaOH=NaAlO2+2H2O、Be(OH)2+2NaOH=Na2BeO2+2H2O,D项正确;答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目