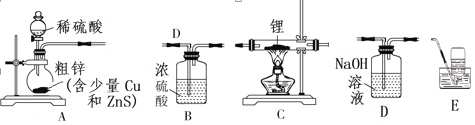
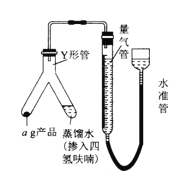
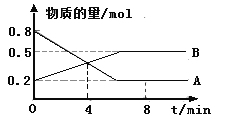
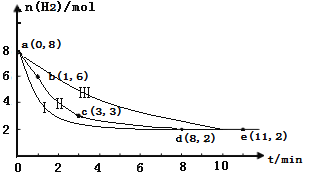
题目内容
【题目】一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是
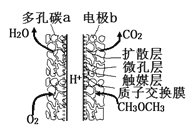
A. 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极
B. 电极b上发生的反应为:CH3OCH3-12e-+3H2O=2CO2+12H+
C. H+由b电极向a电极迁移
D. 二甲醚直接燃料电池能量密度( kW·h·kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍
【答案】A
【解析】A、采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极,而不是负极,A错误;B、电极b是负极发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+,B正确;C、阳离子向正极移动,所以H+由b电极向a电极迁移,C正确;D、二甲醚提供1mol电子所需质量为:46/12g,而甲醇(CH3OH)提供1mol电子所需质量为:30/6g,所以二甲醚直接燃料电池能量密度( kWhkg-1)约为甲醇(CH3OH)直接燃料电池能量密度为:5÷(46/12)约为1.4倍,D正确;答案选A。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p | |||||||||||||||
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式:____。
(2)c与a形成6个原子组成分子结构简式:__________,该分子是:_______(填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是__________________________;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
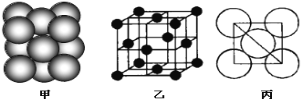
晶胞中i原子的配位数为___________,一个晶胞中i原子的数目为____________。