题目内容
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)?C2(H2) |
| c(CH3OH) |
| c(CO)?C2(H2) |
减小
减小
(填“增大”、“减小”、“不变”).(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
b、c
b、c
.a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
Cu2O+CO?2Cu+CO2
Cu2O+CO?2Cu+CO2
(用化学方程式表示).(5)能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质.常温下,1g甲醇完全燃烧生成液态水时放出22.7kJ的能量,写出甲醇燃烧热的热化学方程式
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol
.分析:(1)根据化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;根据温度对化学平衡、平衡常数的影响.(2)先根据图象依据υ=
求出求出υ(CH3OH),然后根据速率之比等于化学计量数之比求出υ(H2)
(2)缩小容器的体积相当于减压,然后根据压强对浓度、速率和化学平衡的影响来解答;
(4)根据Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应;
(5)根据热化学方程式的书写方法及系数的含义;
| ||
| △t |
(2)缩小容器的体积相当于减压,然后根据压强对浓度、速率和化学平衡的影响来解答;
(4)根据Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应;
(5)根据热化学方程式的书写方法及系数的含义;
解答:解:(1)因化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
,由图可知,升高温度,平衡逆向移动,则化学平衡常数减小,故答案为:
;减小.
(2)由图象可知,在500℃时,时间达到tB时,甲醇的物质的量为nB,依据υ(CH3OH)=
=
mol?(L?min)-1,由速率之比等于化学计量数之比求出,υ(H2)=υ(CH3OH)=2×
mol?(L?min)-1=
mol?(L?min)-1;故答案为:
mol?(L?min)-1
(3)其他条件不变时,将处于E点的体系体积压缩到原来的
,容器的体积减小,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,
故选:b、c;
(4)二氧化有利于抑制反应 Cu2O+CO 2Cu+CO2向正反应方向移动,维持Cu2O的量不变,
2Cu+CO2向正反应方向移动,维持Cu2O的量不变,
故答案为:Cu2O+CO 2Cu+CO2.
2Cu+CO2.
(5)因1g甲醇完全燃烧生成液态水时放出22.7kJ的能量,
所以甲醇燃烧热的热化学方程式:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol.
| c(CH3OH) |
| c(CO)?C2(H2) |
| c(CH3OH) |
| c(CO)?C2(H2) |
(2)由图象可知,在500℃时,时间达到tB时,甲醇的物质的量为nB,依据υ(CH3OH)=
| ||
| △t |
| ||
| tB |
| ||
| tB |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)其他条件不变时,将处于E点的体系体积压缩到原来的
| 1 |
| 2 |
故选:b、c;
(4)二氧化有利于抑制反应 Cu2O+CO
 2Cu+CO2向正反应方向移动,维持Cu2O的量不变,
2Cu+CO2向正反应方向移动,维持Cu2O的量不变,故答案为:Cu2O+CO
 2Cu+CO2.
2Cu+CO2.(5)因1g甲醇完全燃烧生成液态水时放出22.7kJ的能量,
所以甲醇燃烧热的热化学方程式:CH3OH(l)+
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
点评:本题考查的知识点较多,综合性较强,注意外界条件对化学平衡移动的影响以及平衡状态的判断,而问题(4)是易错点.

练习册系列答案
相关题目
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题: 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )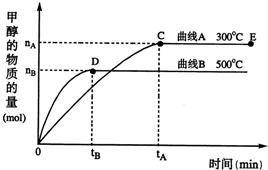 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CH3OH(g)
CH3OH(g) 2Cu+CO2
2Cu+CO2
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题: