题目内容
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
 CH3OH(g)
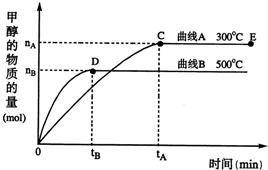
CH3OH(g)根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
减小
减小
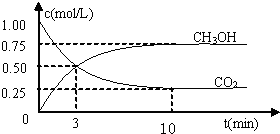
(填“增大”、“减小”或“不变”).(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
bc
bc
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时
| n(H2) |
| n(CH3OH) |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
Cu2O+CO 2Cu+CO2
2Cu+CO2
 2Cu+CO2
2Cu+CO2Cu2O+CO 2Cu+CO2
2Cu+CO2
(用化学方程式表示). 2Cu+CO2
2Cu+CO2(5)使用燃料电池是节能减排的重要手段之一.CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H2=CH3OCH3+CO2 或 2CO+4H2=CH3OCH3+H2O.上述水煤气燃料电池的负极反应方程式:(写1个)
CO+O2--2e-=CO2 H2+O2--2e-=2H2O
CO+O2--2e-=CO2 H2+O2--2e-=2H2O
.(6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:
CH3OCH3(g)+3O2(g)
2CO2(g)+3H2O(l)△H=-1455kJ?mol-1
| 点燃 |
CH3OCH3(g)+3O2(g)
2CO2(g)+3H2O(l)△H=-1455kJ?mol-1
| 点燃 |

分析:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,温度升高时,甲醇的物质的量减小,说明升高温度平衡向逆反应方向移动;
(2)根据甲醇的反应速率计算氢气的反应速率;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
,体系的压强增大,正逆反应速率增大,平衡向正反应方向移动,甲醇的物质的量增加,由于温度不变,则平衡常数不变,达新平衡时,虽然氢气反应一部分,但由于体积的影响大于平衡移动的影响,则氢气的浓度增大;
(4)Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应;
(5)CO和H2都具有还原性,为燃料电池的负极,被氧化失去电子生成CO2和H2O,结合电解质书写电极反应式;
(6)根据生成1mol水放出的热量计算反应热.
(2)根据甲醇的反应速率计算氢气的反应速率;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
(4)Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应;
(5)CO和H2都具有还原性,为燃料电池的负极,被氧化失去电子生成CO2和H2O,结合电解质书写电极反应式;
(6)根据生成1mol水放出的热量计算反应热.
解答:解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,根据反应方程式可知,平衡常数为K=
,由图象可知,当温度升高时,甲醇的物质的量减小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,
故答案为:K=
; 减小;
(2)由图象可知,时间达到tB时,甲醇的物质的量为nB,则甲醇的反应速率为v(CH3OH)=
mol?(L?min)-1,由方程式可知v(H2)=2v(CH3OH)=
mol?(L?min)-1,
故答案为:
mol?(L?min)-1;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
,体系的压强增大,正逆反应速率增大,平衡向正反应方向移动,甲醇的物质的量增加,由于温度不变,则平衡常数不变,达新平衡时,虽然氢气反应一部分,但由于体积的影响大于平衡移动的影响,则氢气的浓度增大,
故答案为:bc;
(4)Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应,反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,反应为Cu2O+CO 2Cu+CO2,
2Cu+CO2,
故答案为:Cu2O+CO 2Cu+CO2;
2Cu+CO2;
(5)CO和H2都具有还原性,为燃料电池的负极,被氧化失去电子生成CO2和H2O,电极反应为CO+O2--2e-=CO2,或H2+O2--2e-=2H2O,
故答案为:CO+O2--2e-=CO2,H2+O2--2e-=2H2O;
(6)由图象可知生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,
所以热化学方程式为CH3OCH3(g)+3O2(g)
2CO2(g)+3H2O(l)△H=-1455kJ?mol-1,
故答案为:CH3OCH3(g)+3O2(g)
2CO2(g)+3H2O(l)△H=-1455kJ?mol-1.
| c(CH3OH) |
| c(CO)?c2(H2) |
故答案为:K=
| c(CH3OH) |
| c(CO)?c2(H2) |
(2)由图象可知,时间达到tB时,甲醇的物质的量为nB,则甲醇的反应速率为v(CH3OH)=
| nB |
| 3tB |
| 2nB |
| 3tB |
故答案为:
| 2nB |
| 3tB |
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
故答案为:bc;
(4)Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应,反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,反应为Cu2O+CO
 2Cu+CO2,
2Cu+CO2,故答案为:Cu2O+CO
 2Cu+CO2;
2Cu+CO2;(5)CO和H2都具有还原性,为燃料电池的负极,被氧化失去电子生成CO2和H2O,电极反应为CO+O2--2e-=CO2,或H2+O2--2e-=2H2O,
故答案为:CO+O2--2e-=CO2,H2+O2--2e-=2H2O;
(6)由图象可知生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,
所以热化学方程式为CH3OCH3(g)+3O2(g)
| 点燃 |
故答案为:CH3OCH3(g)+3O2(g)
| 点燃 |
点评:本题考查较为综合,题目难度较大,本题注意(4)为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注