题目内容
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )分析:A.根据平衡时甲醇的物质的量变化判断温度对平衡移动的影响,进而判断反应热效应;
B.增大压强平衡向气体体积减小的方向移动;
C.平衡常数只受温度影响;
D.恒容条件下,通入稀有气体,反应混合物各组分浓度不变,平衡不移动.
B.增大压强平衡向气体体积减小的方向移动;
C.平衡常数只受温度影响;
D.恒容条件下,通入稀有气体,反应混合物各组分浓度不变,平衡不移动.
解答:解:A.由图可知,升高温度到达平衡时,甲醇的物质的量减小,说明平衡向逆反应方向移动,故正反应为放热反应,故A正确;
B.正反应为气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即向正反应方向移动,故B错误;
C.平衡常数只受温度影响,使用催化剂,平衡常数不变,故C错误;
D.恒容条件下,通入稀有气体,反应混合物各组分浓度不变,平衡不移动,故D错误,
故选A.
B.正反应为气体体积减小的反应,增大压强平衡向气体体积减小的方向移动,即向正反应方向移动,故B错误;
C.平衡常数只受温度影响,使用催化剂,平衡常数不变,故C错误;
D.恒容条件下,通入稀有气体,反应混合物各组分浓度不变,平衡不移动,故D错误,
故选A.
点评:本题考查化学平衡影响因素与平衡图象,难度中等,注意理解外界条件对平衡移动的影响,D选项为易错点,注意稀有气体通入是否会引起浓度的变化,再根据浓度变化等效为压强变化理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题: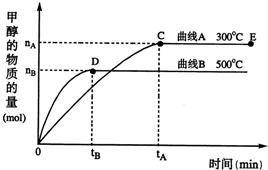 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):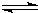 CH3OH(g)
CH3OH(g) 2Cu+CO2
2Cu+CO2
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题: