题目内容
7.在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )| A. | $\frac{1}{5}$mol | B. | $\frac{2}{5}$ mol | C. | $\frac{3}{5}$mol | D. | $\frac{11}{5}$ mol |
分析 反应中Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为3mol,则1molCuSO4氧化P0.2mol.
解答 解:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为$\frac{15}{5}$=3mol,则1molCuSO4氧化P$\frac{1}{5}$mol;
故选A.
点评 本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
18.下列变化属于物理变化的是( )
| A. | 煤的干馏 | B. | 裂解 | ||
| C. | 从煤焦油中得到苯、甲苯、二甲苯等 | D. | 古代植物变质成煤 |
12.现有反应S2Cl2(l)(橙黄色)+Cl2(g)?2SCl2(l)(鲜红色)△H=-50.16kJ•mol-1.在密闭容器中达到平衡,下列说法错误的是( )
| A. | 温度不变,增大容器的体积,S2Cl2的转化率降低 | |
| B. | 温度不变,缩小容器体积,液体的颜色加深 | |
| C. | 压强不变,升高温度,液体的颜色变浅 | |
| D. | 体积不变,降低温度,氯气的转化率降低 |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,PH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 室温下,0.100 mol•L-1碳酸钠溶液中,CO32-数目小于0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
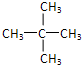 .
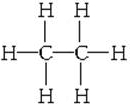
.
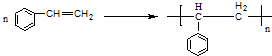 .
.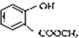 含有的官能团的名称为酚羟基、酯基.
含有的官能团的名称为酚羟基、酯基.