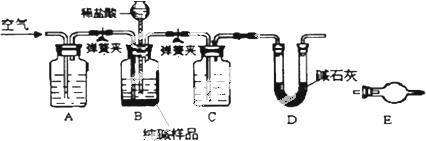
题目内容
12.现有反应S2Cl2(l)(橙黄色)+Cl2(g)?2SCl2(l)(鲜红色)△H=-50.16kJ•mol-1.在密闭容器中达到平衡,下列说法错误的是( )| A. | 温度不变,增大容器的体积,S2Cl2的转化率降低 | |
| B. | 温度不变,缩小容器体积,液体的颜色加深 | |
| C. | 压强不变,升高温度,液体的颜色变浅 | |
| D. | 体积不变,降低温度,氯气的转化率降低 |
分析 A、温度不变,增大容器的体积,压强减小,平衡向着气体体积增大的方向移动;
B、温度不变,减小容器体积,压强增大,平衡向着气体体积减小的方向移动;
C、正反应是放热反应,升温,平衡向着吸热反应方向移动;
D、正反应是放热反应,降温,平衡向着放热反应方向移动.
解答 解:A、温度不变,增大容器的体积,压强减小,平衡向着气体体积增大的方向移动,即向着逆反应方向移动,S2Cl2的转化率降低,故A正确;
B、减小容器体积,压强增大,平衡向着气体体积减小的方向移动,即向着正反应方向移动,故溶液由橙黄色变为鲜红色,颜色加深,故B正确;
C、正反应是放热反应,升温,平衡向着吸热反应方向移动,即向着逆反应方向移动,溶液由鲜红色变为橙黄色,颜色变浅,故C正确;
D、正反应是放热反应,降温,平衡向着放热反应方向移动,即向着正反应方向移动,则氯气的转化率升高,故D错误;
故选D.
点评 本题考查了影响化学平衡的因素,掌握浓度、压强、温度、催化剂对化学平衡的影响是解题的关键,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | 淀粉碘化钾溶液在空气中变蓝:4I+O2+2H2O═4OH-+2I2 | |
| B. | 用NaOH溶液吸收氯气:2OH-+2Cl2═2Cl-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ |
3.常温下,下列液体pH>7的是( )
| A. | 正常的人体血液 | B. | 食盐溶液 | C. | 橙汁 | D. | 胃液 |
7.在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
| A. | $\frac{1}{5}$mol | B. | $\frac{2}{5}$ mol | C. | $\frac{3}{5}$mol | D. | $\frac{11}{5}$ mol |
17.下列大小顺序排列不正确的组合是( )
| A. | 气态氢化物的稳定性:H2O>H2S>SiH4 | |
| B. | 离子半径:Cl->O2->Mg2+ | |
| C. | 物质酸性:H3PO4>H2SO4>HClO4 | |
| D. | 熔点:KCl>KI>K |
4.室温下0.1mol/L的NH4CN溶液的pH等于9.32.下列说法错误的是( )
| A. | 上述溶液能使甲基橙试剂变黄色 | |
| B. | 室温下,NH3•H2O是比HCN更弱的电解质 | |
| C. | 上述溶液中CN-的水解程度大于NH4+的水解程度 | |
| D. | 室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |
1.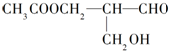 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
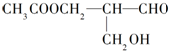 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质,它就一定具有光学活性,某物质如图,具有光学活性,发生下列哪个反应后生成的有机物无光学活性( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 与浓溴水作用 |
2.下列粒子的结构示意图中,表示氯离子的是( )
| A. | 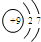 | B. | 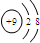 | C. | 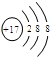 | D. |  |