题目内容
15.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | KCl和K | D. | CO2和H2O |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物一定含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键,以此解答.
解答 解:A.NH3是分子晶体,NH3中只含共价键;NH4Cl是离子晶体,NH4Cl中含有离子键和共价键,故A错误;
B.HCl是分子晶体,SiO2为原子晶体,故B错误;
C.KCl为离子晶体,含有离子键,K为金属晶体,含有金属键,故C错误;
D.H2O和CO2都是分子晶体,CO2和H2O都只含共价键,故D正确;
故选D.
点评 本题考查化学键类型和晶体类型的关系,为高频考点,侧重双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键,难度不大.

练习册系列答案
相关题目
5.下列各组溶液中,不用任何其他试剂就能鉴别的是( )
| A. | Na2SO4 H2SO4 AlCl3 BaCl2 | B. | HCl NaOH K2SO4 NaHCO3 | ||
| C. | AlCl3 KHCO3 NaCl Na2SO4 | D. | NaOH FeCl3 MgCl2 K2SO4 |
6.下列变化是物理变化的是( )
| A. | 钝化 | B. | 焰色反应 | C. | 风化 | D. | 电解质溶液导电 |
20.食品添加剂通常必须在一定范围内使用,否则会损害人体健康,滥用下列食品添加剂会导致癌症发生率增加的是( )
| A. | KIO3 | B. | 苯甲酸钠 | C. | 维生素E | D. | NaNO2 |
7.分子式为C8H10O的苯的衍生物,其分子中含有两个互为对位的取代基,则其中不与NaOH 溶液反应的物质的种数为( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
8.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 正极附近SO42-浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 正极反应式为Zn-2e-═Zn2+ | |
| D. | 该原电池工作过程中电解质溶液的pH值增大 |
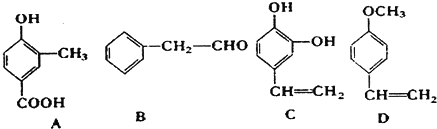
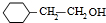 ;1molC最多能与3mol Br2发生反应.
;1molC最多能与3mol Br2发生反应.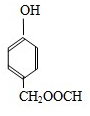 H
H .G和NaOH溶液反应的化学方程式为
.G和NaOH溶液反应的化学方程式为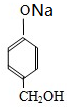 +HCOONa+H2O.
+HCOONa+H2O.
 ;
;