题目内容
17.下列说法中不正确的是( )| A. | 化学键是两个原子之间的相互作用力 | |
| B. | 若形成新化学键释放的能量大于断裂旧化学键吸收的能量,则该化学反应是放热反应 | |
| C. | 某些吸热反应不加热也可能发生反应 | |
| D. | 氮气在通常状况下化学性质很稳定,是因为其分子内部的共价键很难被破坏 |
分析 A.化学键是相邻原子之间强烈的相互作用;
B.根据断键稀释的能量和形成化学键放出能量的相对大小确定反应热;
C.反应的热效应与反应的条件无关;
D.氮气中氮原子间存在氮氮三键,键能较大.
解答 解:A.化学键是“相邻”原子之间的相互作用,而不是原子间的相互作用,故A错误;
B.根据断键稀释的能量和形成化学键放出能量的相对大小确定反应热,如果形成新化学键释放的能量大于断裂旧化学键吸收的能量,则该化学反应是放热反应,如果形成新化学键释放的能量小于断裂旧化学键吸收的能量,则该化学反应是吸热反应,故B正确;
C.反应的热效应与反应的条件无关,如氢氧化钡与铵盐与碱的反应,故C正确;
D.氮气中氮原子间存在氮氮三键,键能较大,导致氮气在通常状况下化学性质很稳定,故D正确;
故选A.
点评 本题考查了化学键的定义、化学反应与能量的关系等知识点,难度不大,注意化学键定义中强调“相邻”二字,为易错点.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | 用价层电子对互斥理论预测H2S和BF3的立体结构为:V形和平面三角形 | |
| B. | 分子晶体中一定存在分子间作用力,不一定存在共价键 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化 |
8.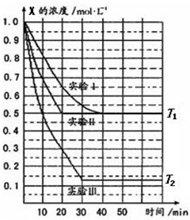 某同学在三个容积相同的密闭容器中,研究三种不同条件下化学反应
某同学在三个容积相同的密闭容器中,研究三种不同条件下化学反应
2X(g)?Y(g)+W(g)的进行情况,其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0mol/L,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示,下列说法不正确的是( )
 某同学在三个容积相同的密闭容器中,研究三种不同条件下化学反应
某同学在三个容积相同的密闭容器中,研究三种不同条件下化学反应2X(g)?Y(g)+W(g)的进行情况,其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0mol/L,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示,下列说法不正确的是( )
| A. | 与实验I相比,实验II可能使用了催化剂 | |
| B. | 与实验I相比,实验III若只改变温度,则温度T1<T2,该反应是吸热反应 | |
| C. | 在实验I、II、III中,达到平衡状态时X的体积百分含量相同 | |
| D. | 若起始浓度c(X)=0.8mol/L,c(Y)=c(W)=0,其余条件与实验I相同,则平衡浓度c(X)=0.4mol/L |
12.下列各对物质中,互为同系物的是( )
| A. | CH3-CH2-CH3和 CH3-CH=CH2 | B. | CH3-CH=CH2和 CH3-CH2-CH=CH2 | ||
| C. | CH3-CH3和 CH3-CH=CH2 | D. | CH2=CH2和 CH≡CH |
2.下列说法正确的是( )
| A. | 光导纤维和太阳能电池的主要材料都是二氧化硅 | |
| B. | 铵盐受热易分解,一定生成氨和相应的酸 | |
| C. | Cl2通入冷的消石灰中可制得漂白粉,漂白粉的有效成分是Ca(ClO)2 | |
| D. | 浓硝酸保存在棕色玻璃瓶中,烧碱溶液保存在无色带磨砂玻璃塞的玻璃瓶中 |
9.下列实验式中,无需知道相对分子质量即可确定分子式的是( )
| A. | CH3O | B. | CH | C. | CH2O | D. | C2H3 |
17.下列反应中,属于取代反应的是( )
| A. | 苯在一定条件下与溴反应生成溴苯 | B. | 乙烯通入溴的四氯化碳溶液 | ||
| C. | 镍催化下苯与氢气反应 | D. | 铜催化下乙醇与氧气反应 |
 .
.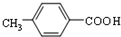 ②
②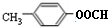
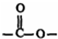 基团.
基团.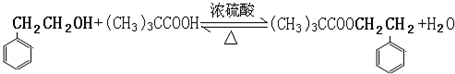 .
.