题目内容
(每空2分,共12分)键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低? (填“能”或“不能”),原因是 。
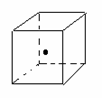
(3)如图立方体中心的“· ”表示金刚石晶体中的一个原子,请在立方体的顶点用“· ”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低? (填“能”或“不能”),原因是 。
(3)如图立方体中心的“· ”表示金刚石晶体中的一个原子,请在立方体的顶点用“· ”表示出与之紧邻的碳原子

(4)工业上高纯硅可通过下列反应制取:SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________。
(1)>,<
(2)不能,物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多。因此不能都根据键能来判断物质的熔点高低。
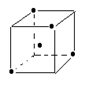
(3)
 (4)+236 kJ/mol )
(4)+236 kJ/mol )
(2)不能,物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多。因此不能都根据键能来判断物质的熔点高低。
(3)

 (4)+236 kJ/mol )
(4)+236 kJ/mol )(1)碳化硅和硅都是原子晶体,其熔点大小和共价键强弱有关系。形成共价键的原子半径越小,共价键越强,碳原子半径小于硅原子的,所以碳化硅的熔点高于硅放的。四氯化硅是分子晶体,二氧化硅是原子晶体,所以四氯化硅的熔点小于二氧化硅的。
(2)由于物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多。因此不能都根据键能来判断物质的熔点高低。
(3)金刚石中每一个碳原子与周围的4个碳原子连接,构成正四面体,所以结构如图。
(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此反应热是360 kJ/mol×4+436 kJ/mol×2-176 kJ/mol×2-431 kJ/mol×4=+236 kJ/mol。
(2)由于物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多。因此不能都根据键能来判断物质的熔点高低。
(3)金刚石中每一个碳原子与周围的4个碳原子连接,构成正四面体,所以结构如图。
(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此反应热是360 kJ/mol×4+436 kJ/mol×2-176 kJ/mol×2-431 kJ/mol×4=+236 kJ/mol。

练习册系列答案
相关题目
 等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为 形。
等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为 形。