题目内容
(10分 )Ⅰ.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
⑴.科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。
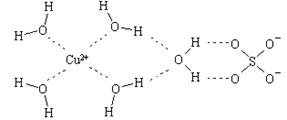
⑵.科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
①写出基态Cu原子的核外电子排布式
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)
Ⅱ.常见有机化合物,如①CH2=CH2、②CH≡CH、③ 等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为 形。
等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为 形。
⑴.科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
⑵.科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)
Ⅱ.常见有机化合物,如①CH2=CH2、②CH≡CH、③
 等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为 形。
等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子中心原子C也是采取sp2杂化成键,预测HCHO分子的立体结构为 形。Ⅰ.MgO>CaO>NaCl>KCl
①1s22s22p63s23p63d104s1或[Ar] 3d104s1 ②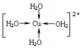 Ⅱ.①③ 平面三角
Ⅱ.①③ 平面三角
①1s22s22p63s23p63d104s1或[Ar] 3d104s1 ②
 Ⅱ.①③ 平面三角
Ⅱ.①③ 平面三角Ⅰ.(1)根据数据可知形成离子键的离子半径越小,所带电荷数越多,离子键越强,晶格能越大。镁离子半径小于钙离子半径,所以氧化镁的晶格能大于氧化钙的,熔点由高到低的顺序是MgO>CaO>NaCl>KCl。
(2)①根据构造原理可知基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar] 3d104s1。
②胆矾晶体中水合铜离子是通过配位键形成的配合物,其中水是配体,所以结构简式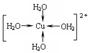 。
。
Ⅱ.碳碳双键是平面型结构,所以是sp2杂化。乙炔是直线型结构,碳原子是sp杂化。HCHO中碳原子和2个氢原子形成单键,和氧原子形成双键,所以是sp2杂化,属于平面三角形结构。
(2)①根据构造原理可知基态Cu原子的核外电子排布式1s22s22p63s23p63d104s1或[Ar] 3d104s1。
②胆矾晶体中水合铜离子是通过配位键形成的配合物,其中水是配体,所以结构简式
 。
。Ⅱ.碳碳双键是平面型结构,所以是sp2杂化。乙炔是直线型结构,碳原子是sp杂化。HCHO中碳原子和2个氢原子形成单键,和氧原子形成双键,所以是sp2杂化,属于平面三角形结构。

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目